簡介
鋅錳電池可以分為:酸性鋅錳電池和鹼性鋅錳電池
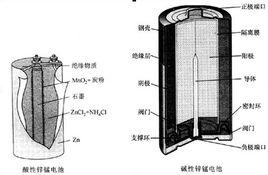
正極材料中間插入一根碳棒,作為引出電流的導體。在正極和負極之間有一層增強的隔離紙,該紙浸透了含有氯化銨和氯化鋅的電解質溶液,金屬鋅的上部被密封。這種電池是19世紀60年代法國的勒克蘭謝(Leclanche)發明的,故又稱為勒克蘭謝電池或炭鋅乾電池.
材料
①二氧化錳:俗稱錳粉。是正極的活性物質,直接參加電化學反應,是決定電池電荷量的主要材料。根據其製備方法可以分為天然二氧化錳、化學二氧化錳和電解二氧化錳。其中電解二氧化錳的電化學活性最高,化學二氧化錳次之。
②石墨:正極原料之一。有顯晶型(俗稱鱗片狀)和隱晶型(俗稱土狀)兩種。石墨不參加電化學反應,有良好的導電性,具有吸附性和粘著性。摻入電芯中可以提高電芯的導電性。它粘著在多孔錳粉的周圍吸收一定量的電液,使電芯保持一定的水分,可充分提高錳粉的利用率。
③氯化銨:是鋅錳電池電解液的主要成分。其作用是:補充放電過程中由於正極反應減少的H+;在正極中也加入一定量的固體氯化銨,以補充放電時電解液中氯化銨的減少;增強電解液的導電性。
④氯化鋅:用於電解液中。主要作用有:減緩鋅片腐蝕,保持電解液中的水分,破壞澱粉的鏈狀結構,加快電解液的糊化速度,減少正極電芯在放電過程中pH值的提高。
⑤鋅:負極活性物質,兼作電池的容器和負極引電體,是決定電池貯存性能的主要材料。在鋅片中含有少量的鎘和鉛。鎘能增強鋅的強度,鉛能改進鋅的延展加工性能。鎘與鉛均能提高氫在鋅電極上的過電位,減少鋅電極的自放電,減緩鋅片的腐蝕和氫氣的釋放。鋅片中若含有Cu、Fe、Ni等,將降低H2在鋅電極上析出的過電位,加速電池在貯存過程中的自放電,因此這些有害雜質必須嚴格控制。
化學反應
酸性鋅錳電池可表示為:(-)Zn|NHCl(20%)ZnCl|MnO,C(+)
儘管這種電池的歷史悠久,但對它的電化學過程尚未完全了解,通常認為放電時,電池中的反應如下:正極為陰極,錳由四價還原為三價
MnO+H +e →MnO(OH)
負極為陽極,鋅氧化為二價鋅離子:
Zn+2NHCl--→Zn(NH)Cl+2H +2e
總的電池反應為:
2MnO+Zn+2NHCl--→2MnO(OH)+Zn(NH)Cl 實踐經驗表明,該電池的電流-電壓特性和二氧化錳的來源有關,也直接地依賴於錳的氧化價態、晶粒的大小及水化程度等。目前已全部以ZnCl2電解液代替NH4Cl,充分說明Zn與Cl配合[ZnCl2],而不必有NH4存在,放電前pH=5,放電後pH上升到pH=7為中性。
原理
Zn(-)失去電子:Zn-2e→Zn2+(氧化反應)
C(+)得到電子:2NH4++2e→2NH3+H2(還原反應)
實際乾電池正極周圍還有二氧化錳,它起什麼作用呢?在模擬乾電池實驗中可以看到,電流會迅速減小,這是由於碳棒上吸附一層氫氣,內電阻增加而使反應停止的緣故。二氧化錳把正極上產生的H2氧化成水,而本身則被還原為MnO(OH)。顯然沒有二氧化錳的乾電池是沒有實用價值的。
另外,產生的NH3被糊狀電解質中的Zn吸收為Zn(NH3)2Cl2。因此,乾電池工作時,負極的反應材料是鋅,正極是二氧化錳,故而它的學名叫鋅錳電池,輸出電壓為 1.5伏。乾電池中總反應可大體表示為:Zn+2MnO2+2NH4Cl→2 MnO(OH)+Zn(NH3)2Cl2。
特點
(1)開路電壓為1.55V~1.70V;
(2)原材料豐富,價格低廉;
(3)型號多樣1號~5號;
(4)攜帶方便,適用於間歇式放電場合。缺點是:在使用過程中電壓不斷下降,不能提供穩定電壓,且放電功率低,比能量小,低溫性能差,在-20℃即不能工作。在高寒地區只可使用鹼性鋅錳乾電池。由於廢電池污染比較嚴重,產量逐年降低;