軟硬酸鹼理論
正文
將酸和鹼根據性質的不同各分為軟硬兩類的理論。1963年由R.G.皮爾孫提出。本理論適用於說明多種化學現象,如酸鹼反應、金屬和配位體間的作用、配離子形成(見配位化學),共價鍵和離子鍵的形成等。簡史 1958年S.阿爾蘭德、J.查特和N.R.戴維斯根據某些配位原子易與Ag+、Hg2+、Pt2+配位,而另一些配位原子易與Al3+、Ti4+等配位, 將金屬離子和配位原子分成a和b兩類。a類金屬離子包括鹼金屬、 鹼土金屬、高氧化數的輕過渡元素Ti4+、Fe3+、Cr3+和H+;b類金屬離子包括較重的、低氧化數的過渡元素Cu+、Ag+、Hg2+、Pt2+。a類金屬離子的特性隨氧化數升高而加強,它優先與體積小、電負性大的原子結合;b類金屬離子形成化合物的穩定性,因配位原子的電負性增大而減弱:
C≈S>I>Br>Cl>N>O>F
此順序幾乎(不是全部)和 a類金屬離子形成化合物的穩定性順序相反(見表),如與水相比,硫醚R2S (R為烷基)與b類金屬離子Hg2+、Pt2+、Pd2+等配位傾向較強。這個經驗性總結有助於判斷配位化合物的穩定性。 軟硬酸鹼理論
軟硬酸鹼理論 軟硬酸鹼理論
軟硬酸鹼理論套用 軟硬酸鹼理論可說明多種化學現象。
取代反應 酸鹼取代作用傾向於形成硬-硬、軟-軟化合物:
HI(g)+F-(g)─→HF(g)+I-(g) ΔH=-263.6kJ/mol
式中g為氣態。H+是硬酸,優先與硬鹼F-結合,反應放熱。雙取代反應也傾向於生成硬-硬、軟-軟化合物,反應放熱,如Li+、Be2+是硬酸(Be2+比Sr2+硬),F-是硬鹼,I-是軟鹼,反應如下:
LiI+CsF─→LiF+CsIΔH=-65.7kJ/mol
BeI2+SrF2─→BeF2+SrI2 ΔH=-200.8kJ/mol
一般軟-硬化合物不夠穩定,如CH2F2易分解:
2CH2F2(g)─→CH4(g)+CF4(g)
硬酸Mg2+、Ca2+、Sr2+、Ba2+、Al3+等在自然界的礦物都是與硬鹼O2-、F-、CO娫、SO娸 等的化合物,而軟酸Ag+、Hg2+等主要是與軟鹼S2-等的化合物。高氧化數金屬的化合物都是氧化物和氟化物,屬硬-硬化合物,如OsO4、Mn2O7、IF7、OsF6;而某些低氧化數的金屬與軟鹼的化合物比較穩定,如Mn(CO)5Cl。
溶解度 物質的溶解也是溶質和溶劑間的酸鹼反應。常用的硬鹼溶劑水和氨,較易溶解硬酸-硬鹼的化合物,如LiCl、MgSO4、KNO3、…;而軟鹼溶劑如苯等,易溶解軟酸Br2、I2。
軟酸Ag+與硬鹼F-的化合物易溶於水,而軟酸Ag+與軟鹼Br-、I-的化合物難溶。Ag+與硬鹼NH3配合物的穩定常數lgβ2=7.4。對軟酸Ag+來說,鹼的軟性減弱順序是:

金屬的電極電勢
M(s)─→Mn+(aq)+ne
式中s為固態;aq為水溶液。金屬離子化傾向取決於三個過程的能量: M(s)─→M(g) (升華)
M(g)─→Mn+(g)+ne (電離)
Mn+(g)+ne─→Mn+(aq)+ne (水合)
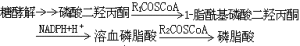
 軟硬酸鹼理論
軟硬酸鹼理論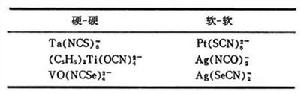 軟硬酸鹼理論
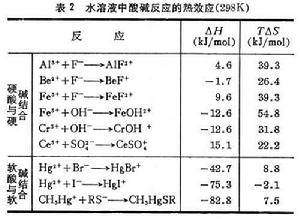
軟硬酸鹼理論加合反應熱效應 表2是水溶液中的幾個酸鹼反應實例,前六個都是硬酸-硬鹼的結合,ΔH(焓變)的絕對值都不大,TΔS(T為溫度;ΔS為熵變)是較大的正值,其正向反應的推動力是TΔS;軟酸-軟鹼結合的ΔH為負值,TΔS也是較小的值。
 軟硬酸鹼理論
軟硬酸鹼理論催化反應 有機化學中的弗里德-克雷夫茨反應以無水氯化鋁AlCl3作催化劑。AlCl3是硬酸,與RCl中的硬鹼Cl-結合而活化:
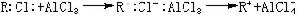
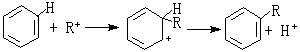
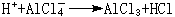
金屬催化劑中毒問題,也可從軟硬酸鹼規則來理解。一般零氧化數的金屬都是軟酸,易與軟鹼反應而中毒。如鐵(軟酸)催化劑,易與軟鹼如一氧化碳、硫、磷、砷等發生不可逆反應而引起鐵中毒;硬鹼如氧、水與鐵發生可逆反應,不會引起鐵中毒。
取代反應的速率 一般形成軟酸-軟鹼化合物的反應速率較高。CH3Cl是軟酸CH幦和硬鹼Cl-的化合物,其中的CH幦能與軟鹼RS-、I-、S2O娫、R3P等發生較快的取代反應,而與硬鹼RO-、R3N、F-、SO娸等的取代反應速率較低:
CH3Cl+RS-─→CH3SR+Cl-
CH3Cl+RO-─→CH3OR+Cl-
前一個反應的速率是後者的100倍。又如HI和AgF都是軟-硬化合物。HI中的I-(軟鹼)與Ag+(軟酸)發生快反應。同理,AgF 中的F-(硬鹼)與Al3+(硬酸)也發生快反應:
HI+Ag+─→AgI+H+
3AgF+Al3+─→AlF3+3Ag+
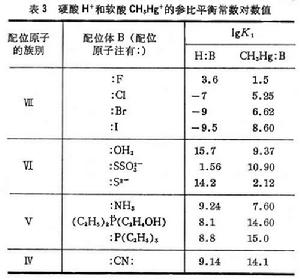
為了統一酸鹼軟硬標度, 皮爾孫以H+(質子)作為硬酸、CH3Hg+(甲基汞離子)作為軟酸的實驗標準來測定它們與鹼(B)反應的平衡常數,以決定鹼的相對反應性能: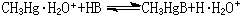
 軟硬酸鹼理論
軟硬酸鹼理論參考書目
R.G.Pearson,Journal of Chemical Education, 45,pp.581~587、643~648, 1968.
