理論簡介
規則溶液理論於20世紀20年代後期由J.H.希爾德布蘭德建立。其成就在於以純組分的摩爾體積和溶解度參數來計算溶液的過量吉布斯函式以及活度係數,所導出的過量吉布斯函式恆大於零,不適用於對理想溶液負偏差的溶液,比較成功地解釋了碘的溶解度以及某些溶質在相當廣泛的非極性溶劑中的溶解度。
理論內容
該理論的要點為:假定兩種液體分子的大小沒有顯著差別,沒有由於偶極或氫鍵等因素所引起的溶液中分子的特殊取向,分子在溶液中作完全無規則的混合,在等容條件下,摩爾數為 n1和 n2的兩種液體混合,具有與理想溶液相同的混合熵:
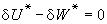 (1)
(1)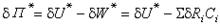 蒸發能
蒸發能 二元混合液體,其蒸發能為
二元混合液體,其蒸發能為式中NA為阿伏伽德羅數; V為液體的摩爾體積。對於摩爾數為 n1和 n2的二元混合液體,其蒸發能為:這裡在理論處理上作了些近似和簡化,包括假定兩個不同種分子的作用能等於兩個同種分子的作用能的幾何平均值:
ε12=(ε11ε22)┩
可導出兩種非極性液體的混合能Δ EM:
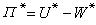 混合能
混合能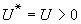 體積分數
體積分數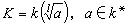 γ1和γ2
γ1和γ2式中 x1和 x2為組分的摩爾分數;δ1和δ2為組分的溶解度參數; φ1和 φ2為組分的體積分數:活度係數 γ1和 γ2見下式: