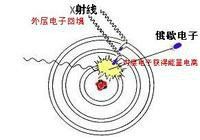
定義
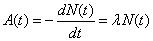 公式
公式活度(activity)也叫衰變率(decay rate),指樣品在單位時間內衰變掉的原子數,即某物質的“有效濃度”,或稱為物質的“有效莫爾分率”。
公式
單位為貝克(Bq)
 活度計
活度計1Bq=1次放射性衰變/s
常用單位還有居里(Ci)
1Ci=3.7*10^10Bq
大約相當於1g 226Ra的活度
計算公式如圖
其中N(t)代表t時刻的原子核數目,λ代表衰變常數
為使理想溶液(或極稀溶液)的熱力學公式適用於真實溶液,用來代替濃度的一種物理量。
背景
在電解質溶液中,由於離子之間相互制約作用的存在,使得離子不能發揮出其濃度數值所示的作用。於是引入了
正文
為使理想溶液(或極稀溶液)的熱力學公式適用於真實溶液,用來代替濃度的一種物理量。
活度係數 絕大多數的冶金反應都有溶液(固溶體、冶金熔體及水溶液)參加,而這些溶液經常都不是理想溶液。要進行定量的熱力學計算和分析,溶液中各組分的濃度必須代以活度。活度是組分的有效濃度(或稱熱力學濃度)。組分的濃度必須用一係數校正,方能符合於若干物理化學定律(例如質量作用定律、拉烏爾定律、亨利定律、分配定律等等),此校正係數稱為活度係數。
式中,
為溶液中組分
的活度;
為溶液中組分
的摩爾分數;
為溶液中組分
的活度係數。
由拉烏爾定律及亨利定律計算活度 溶液是由兩種或兩種以上的物質(稱為組分)組成的均一相。如果異種質點(原子、分子或離子)間的作用力和同種質點間的作用力相同,則此溶液稱為理想溶液,而服從拉烏爾定律,也即溶液中組分
的蒸氣壓
與其以摩爾分數表示的濃度
成正比,比例常數是純組分
的蒸氣壓
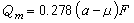 活度
活度:
(2)
真實溶液中各組分的質點有的相互吸引,有的有排斥傾向,導致質點間的作用力不同。只有對組分的濃度加以校正,表示蒸氣壓關係的拉烏爾定律才能適用,
也即符合於真實溶液的拉烏爾定律應寫為:
(3)
活度係數反映有效濃度和實際濃度的差異。
對濃度很稀的真實溶液,一般其溶劑服從拉烏爾定律,其溶質組分
則服從亨利定律,以式(4)表示:
亨利定律與拉烏爾定律的區別在於比例常數
不等於純組分
的蒸氣壓
孂。
式(4)經常寫成式(5),式中
代表溶質的濃度:
對化學工作者,
通常以溶質的重量摩爾濃度
,也即1000克溶劑中溶質的摩爾數來表示:
對冶金工作者,
則以溶質的重量百分數或摩爾百分數
來表示:
在真實溶液絕大部分的濃度範圍內,組分
既不服從拉烏爾定律,又不服從亨利定律。對組分
的活度可按拉烏爾定律計算,得到
,其活度係數用
表示,濃度用
表示;也可按亨利定律計算,得到
,其活度係數根據冶金工作者的慣例用
表示,濃度用
(即百分數)表示:
(8)
(9)
根據拉烏爾定律計算的活度
其標準態為純物質,即當
=1,
=1,因之
=1。
根據亨利定律計算的活度
,其標準態為 1%濃度(對鋼鐵溶液,採用重量1%濃度;對有色金屬溶液,一般採用摩爾1%濃度)的溶液,即當
=1,
=1,因之
=1。
兩種標準態的活度係數的關係式為:
(10)
式中
孂是兩種標準態的活度係數
與
的比值。可以證明,
孂是1%濃度標準態溶液中溶質
按拉烏爾定律計算的活度係數。
由於活度有不同標準態,所以計算出的標準溶解自由焓隨所用活度標準態的不同而有不同值。但無論用哪種活度標準態,對已定條件下的冶金反應,算出的自由焓變數
將永有同一值。
多組分溶液的活度相互作用係數 對多組分的溶液,計算活度時必須知道活度的相互作用係數。
設溶液中有1,2,3,…,
,
,…
,組分,其中組分1為溶劑,則組分
的活度係數
,按1%濃度溶液作標準態,為
(11)
式中,
嫶為組分
對組分
活度係數的影響。
測定
有兩種方法,即同一濃度法及同一活度法。作出lg
對【%
】的曲線,在原點對曲線作切線,其斜率稱為組分
的活度相互作用係數,以
嫶表示。
嫶用同一濃度法測定所得的
嫶值和用同一活度法測定所得的
嫶值有所不同。但對服從亨利定理的很稀溶液,兩者相等,也即:
(12)
聯繫
嫶將式(11)寫成通式,得:
(13)
式(13)中包括
媼一項,也即組分
本身的活度作用係數。
採用純物質為活度標準態,相應地得以下二式:
(14)
(15)
式(13)中右邊也有lg
孂一項,由於服從亨利定律,
孂=1,故從略。
嫶與ε嫶的關係式見式(16)。
(16)
嫶與ε嫐的關係式見式(17)
(17)
式中,
為組分1即溶劑的分子量;
為組分
的分子量;
為組分
的分子量。
式(13)及(15)的線性關係只適用於很稀的溶液。對濃溶液 (如合金熔體及固溶體)由於lg
與【%
】不是線性關係,須採用二級相互作用係數。
活度相互作用係數與溫度有關。一般按規則溶液處理,有
嫶與溫度
的倒數成正比。
活度概念的引入和發展 活度的概念首先由劉易斯(G.N.Lewis)於1907年提出,迅速被套用於電化學,以測定水溶液中電解質的活度係數。30年代中期奇普曼(J.Chipman)將活度概念引用於冶金熔體,並提出金屬溶液中以1%濃度溶液為活度標準態,此建議迅速為冶金物理化學工作者所接受而推廣採用。華格納(C.Wagner)於1952年建議Ln
按麥克勞林(McLaurin)級數展開,奠定了冶金熔體中多組分活度係數計算的基礎。50年代中期圖克道根(E. T.Turkdogan)對同一濃度法與同一活度法測定
進行了比較和研究。50年代末期申克(H.Schenck)及其合作者首先導出
嫶與ε嫶以及
嫶與
嫐準確的相互關係式[即式(16)及(17)]。50~60年代二十年間活度及活度相互作用係數的測定研究工作非常活躍,主要採用化學平衡及溶解度法,已逐步發展自成體系,成為經典的實驗方法。60年代末期固體電解質定氧電池開始作為測定黑色及有色金屬熔體中氧的活度及相互作用係數的良好手段。70年代,黑色冶金的金屬液及熔渣的活度數據已測出不少,但尚不完全。對有色金屬、特別對熔鋶及熔鹽等的活度數據則待做的工作更多。
活度不能解決冶金熔體的結構問題。它能指出組分在真實溶液與理想溶液中熱力學作用上的偏差,但不能提供造成偏差的原因。縱然如此,50~60年代隨著活度數據的積累,不少學者指出鐵液中某些元素
的ε嫶與組分
的原子序數有關,特別是以碳飽和的鐵液中碳的ε嫨與組分
的原子序數有明顯的周期的線性關係。由於高溫實驗條件下測定活度數據的困難,長期以來不少學者提出組分相互間的結構模型,藉助於統計熱力學進行計算,企圖導出一系列公式以之對組分的活度係數進行預測,這對某些二元合金取得了一定的成功,但這些半經驗公式只適用於某一特殊體系的物質,或某一體系的特殊的濃度範圍,迄今尚未能找出適用於不同類型的普遍的合金體系的通用表達式。同樣地,對二元系爐渣也有較好的模型,但尚很不成熟,不足以適用於所有不同類型的二元系爐渣。對三元系或多元爐渣的套用則更談不到了。
通過濃度坐標的適當轉換,對某些二元合金稀溶液的企圖得到活度參數與濃度參數線性關係的嘗試,也尚未獲圓滿的成功。
總之,活度套用於冶金過程,使得冶金反應能定量地進行熱力學計算和分析,在闡明多種反應能否選擇地進行,在控制調整產物能否達到最大產率,在控制冶煉操作如何在最最佳化條件下進行等等方面,已經起了並將繼續起到應有的作用。冶金溶體(包括固溶體及水溶液)中組分活度的測定,利用活度探索熔體結構,以及從構想的結構預測組分的活度及其他熱力學性質等,將仍是今後較長期的較重要的研究課題。
相關圖書
 冶金過程熱力學
冶金過程熱力學魏壽昆:《冶金過程熱力學》,上海科學技術出版社,上海,1980。
魏壽昆:《活度在冶金物理化學中的套用》,中國工業出版社,北京,1964。