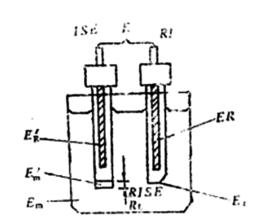
簡介
離子活度是指電解質溶液中參與電化學反應的離子的有效濃度。離子活度(α)和濃度(c)之間存在定量的關係,其表達式為:α=γc式中:α為第i種離子的活度;γ為i種離子的活度係數;c為i種離子的濃度。γ通常小於1,在溶液無限稀時離子間相互作用趨於零,此時活度係數趨於1,活度等於溶液的實際濃度。不同種類離子選擇電極的問世,為選擇性測定離子活度提供了方便。根據能斯特方程,離子活度的對數值與電極電位線性相關,因此可對溶液建立起電極電位與活度的關係曲線,此時測定了電位,即可確定離子活度。測量儀器為電位差計或專用離子活度計。
活度(符號是a)這一名稱最初是用來表示一物質的有效濃度。例如,設0.2克分子濃度的某一鹽類溶液在降低冰點方面與無限稀釋時的理論值相比較只具有0.18克分子的有效濃度,則其活度a值就等於0.18。但在強電解質溶液的理論提出以前,關於活度的本質是不清楚的。誼電解質溶液的理論指出,強電解質在溶液中是完全離解的,由於同號離子相斥,異號離子相吸,因此任一離子是被它所吸引的異號離子的聚集中心,稱為“中心離子”,而在它周圍的反號離子,則稱為“離子霧”,由於離子霧的存在,每一個中心離子都根據圍繞它的離子濃度的大小而具有一定的活度,或具有作為一個離子而運動的能力,因此有人又把活度用來表示已經校正了離子同的相互作用的濃度,並從活度(a)和濃度(c)的此信引出了活度係數(f)的概念。但都浚有給出嚴格的熱力學上的定義.Lewis指出,離子活度與化學位有關,據此他提出如下的離子活度定義:
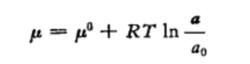 公式
公式離子活度係數
離子活度係數;ion activity coefficient:溶液中離子的不理想程度的一種表示方法,符號為γ。設某離子i的濃度為ci,則ciγi=ai,稱為該離子的活度。將活度替代濃度用於離子平衡反應,理想溶液的關係式仍能適用。但電解質的正、負離子是同時存在的,故正離子的活度a+和負離子的活度a-將同時出現於平衡式中。為了思考方便,引入平均離子活度係數γ±和平均離子活度a±的概念(均指幾何平均)。對於NaCl這樣的1-1價電解質溶液,設其濃度為c,則a±2=a+a-=(c+γ+)(c-γ-)=c2γ±2,或a±=cγ±。由於離子間的靜電作用力很強,即便是極稀的溶液,活度係數仍不能忽略不計,但可以根據德拜(P.Debye)-休克爾理論計算。
離子活度測定
標準比較法
與用玻璃電極測量溶液pH值的方法相似。先配製一個濃度儘可能接近待測溶液的標準溶液,並在標準溶液和待測溶液中分別加入一定的TISAB,然後在相同的條件下測出標準溶液的電動勢ε。和待測溶液的電動勢ε。根據下式即可求出待測離子的濃度:
 公式
公式標準曲線法
在相同條件下測定出系列標準溶液各濃度的電動勢,作ε-lga或ε一lgc標準曲線,標準曲線呈線性關係。然後,在相同條件下測得待測液的電動勢,從標準曲線上查出待測液的濃度。
標準加入法
將標準溶液加人到待測溶液中進行測定的方法。採用該方法可避免由於活度係數變化而造成測定誤差。
假設待測溶液中某離子的濃度為c(x),測定時溶液的體積為V,測得電動勢為ε,而準確加入該離子的標準溶液後,其濃度增加為△c,測得電動勢為ε。假如增加的體積為△V,且△V<<V,則根據Nernst方程有:
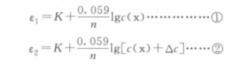 公式
公式②-①可得:
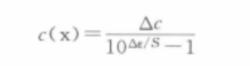 公式
公式