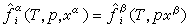相平衡關聯
正文
將相平衡狀態下的溫度、壓力和各相組成等基礎數據,用經驗的或半經驗的方程進行關聯的方法。基礎數據主要由實驗測定。將分散的實驗數據擬合成數學關聯式,就可以在實驗點之間內插或將實驗結果予以適當外推,甚至還能夠根據二元系(有時僅用純物質)的實驗數據來預測多元系的相平衡性質。對於化工設計計算,特別是在套用電子計算機運算時,相平衡關聯式尤為適用。原理 根據相平衡準則,當 α相和β相達到相平衡時,任一組分i在 α相與β相中的逸度相等,即
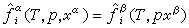 。逸度弙姦和弙婑為溫度T、壓力p和組成(摩爾分數)x的函式,其間具體關係的確定,已超出經典熱力學範疇,必須依靠實驗測定,並套用統計力學或半經驗方法建立模型。這種模型包含一定數量的具有一定物理意義的模型參數θ1、θ2、……。將上述模型代入弙姦=弙婑後,對於組分i,可寫出包含T、p、xα、xβ以及θ1、θ2、……的方程,即Fi(T,p,xα,xβ,θ1,θ2,…)=0。對於有k個組分的系統,可寫出有k個方程的方程組。將實驗得到的一系列T、p、xα、xβ數據代入上述方程組,就可回歸出模型參數。再通過弙姦=弙婑,就可將T、p、xα、xβ聯繫起來,用於相平衡計算和有關化工過程的設計計算。
。逸度弙姦和弙婑為溫度T、壓力p和組成(摩爾分數)x的函式,其間具體關係的確定,已超出經典熱力學範疇,必須依靠實驗測定,並套用統計力學或半經驗方法建立模型。這種模型包含一定數量的具有一定物理意義的模型參數θ1、θ2、……。將上述模型代入弙姦=弙婑後,對於組分i,可寫出包含T、p、xα、xβ以及θ1、θ2、……的方程,即Fi(T,p,xα,xβ,θ1,θ2,…)=0。對於有k個組分的系統,可寫出有k個方程的方程組。將實驗得到的一系列T、p、xα、xβ數據代入上述方程組,就可回歸出模型參數。再通過弙姦=弙婑,就可將T、p、xα、xβ聯繫起來,用於相平衡計算和有關化工過程的設計計算。 方法 化工上遇到的相平衡,大都是汽(氣)液或液液相之間的平衡。關聯這些相平衡的方法,有狀態方程法和活度係數法。
狀態方程法 利用狀態方程計算汽相或氣相和液相逸度的一種相平衡關聯方法。由熱力學導出的逸度弙i的計算式為:
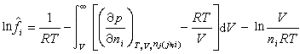
早就知道範德瓦耳斯方程能兼用於汽(氣)液兩相,但準確度不夠。最早用於準確計算汽液平衡的狀態方程是BWR方程,它是一個多參數方程,其關聯有足夠的準確度,然而外推常不夠理想。後來發展成為BWRS方程,可用於輕烴混合物以及含氮、二氧化碳和硫化氫的系統。經過改進的馬丁-侯方程,可取得與 BWRS方程類似的效果。近年來,更多注意比較簡單的三次型方程,如RK方程、SRK方程、PR方程等,它們對烴類系統也能取得較好的結果。
狀態方程法的最大優點是可以用統一的模型處理汽(氣)液兩相,避免了通常遇到的計算標準態逸度的困難,特別適用於高壓下較簡單系統的相平衡計算。對非理想性較強的系統(如含有強極性物質或有氫鍵的物質),由於目前的狀態方程還不能有效地描述其汽(氣)液平衡,故這種系統須套用活度係數法。
活度係數法 利用活度係數方程來計算液相逸度的一種相平衡關聯方法。
對於汽(氣)相,逸度表達為:
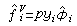
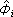 為逸度係數。在低壓下,氣相常作為理想氣體混合物處理,這時
為逸度係數。在低壓下,氣相常作為理想氣體混合物處理,這時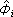 =1。對於實際氣體,可由熱力學導出下述公式,利用狀態方程進行計算:
=1。對於實際氣體,可由熱力學導出下述公式,利用狀態方程進行計算: 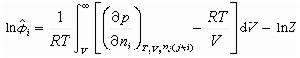
對於液相,逸度弙忥表達式為:
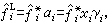 式中
式中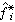 為標準態逸度;
為標準態逸度;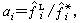 稱為活度, 它是對應於標準態的相對逸度,同時αi=xiγi,它等於摩爾分數xi與活度係數γi的乘積。標準態在原則上可以任意選取,在多數情況下取系統溫度和壓力下的液相純物質作為標準態。即
稱為活度, 它是對應於標準態的相對逸度,同時αi=xiγi,它等於摩爾分數xi與活度係數γi的乘積。標準態在原則上可以任意選取,在多數情況下取系統溫度和壓力下的液相純物質作為標準態。即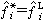 (弙忥為液相純物質的逸度),於是
(弙忥為液相純物質的逸度),於是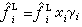 ;當γi=1時,
;當γi=1時, 。此即路易斯-蘭德爾規則。符合此規則的混合物稱為理想溶液。當γi偏離1時,液相為非理想溶液,γi就是此溶液偏離理想程度的度量。有時在系統溫度下得不到液相純物質,例如臨界溫度低於系統溫度的氣體溶解於液體中,或固體組分溶解於液體中,對於這些氣體或固體組分,可取逸度等於亨利常數H的假想狀態作為標準態,即
。此即路易斯-蘭德爾規則。符合此規則的混合物稱為理想溶液。當γi偏離1時,液相為非理想溶液,γi就是此溶液偏離理想程度的度量。有時在系統溫度下得不到液相純物質,例如臨界溫度低於系統溫度的氣體溶解於液體中,或固體組分溶解於液體中,對於這些氣體或固體組分,可取逸度等於亨利常數H的假想狀態作為標準態,即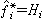 。於是,
。於是,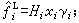 當γi=1時,
當γi=1時,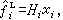 此即1803年英國W.亨利提出關於氣體溶解度的亨利定律。符合此定律的混合物,有時也稱為理想溶液,當然是遵守亨利定律意義上的理想溶液。極稀溶液中的溶質,通常符合亨利定律。
此即1803年英國W.亨利提出關於氣體溶解度的亨利定律。符合此定律的混合物,有時也稱為理想溶液,當然是遵守亨利定律意義上的理想溶液。極稀溶液中的溶質,通常符合亨利定律。 活度係數γi和過量自由焓GE之間,存在著如下的關係:
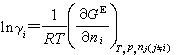
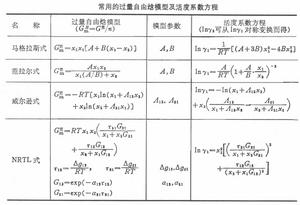 相平衡關聯
相平衡關聯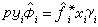
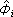 由狀態方程求得;γi由過量自由焓模型求得,皆為溫度、壓力和組成的函式。此式將汽(氣)液平衡時溫度、壓力和汽(氣)液兩相組成聯繫起來。汽液相平衡比(Ki=yi/xi)則相應地表述為:
由狀態方程求得;γi由過量自由焓模型求得,皆為溫度、壓力和組成的函式。此式將汽(氣)液平衡時溫度、壓力和汽(氣)液兩相組成聯繫起來。汽液相平衡比(Ki=yi/xi)則相應地表述為: 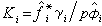
基團貢獻法準確度雖然稍差,但無需實驗數據,在工程上十分有用。活度係數法是目前工程上套用比較成熟的關聯方法。從發展來看,狀態方程法由於兩相使用統一的模型和不需標準態具有明顯的優點,正吸引著更多的注意。
套用 在化工設計中,不論是反應過程、傳質分離過程還是熱質傳遞過程,當涉及相際過程時,就需要進行T、p和各相組成間的相互推算,相平衡關聯主要為了解決這一課題。如一個二元汽液系統,已知液相組成x,要計算在一定壓力下的沸點和平衡汽相組成y;又如物流經過減壓閃急蒸餾或部分冷凝後,要計算汽液兩相的組成和數量,都須使用相平衡關聯所提供的溫度、壓力和各相組成的關係。