定義
生物膜所含的蛋白叫膜蛋白,是生物膜功能的主要承擔者。膜蛋白是膜功能的主要體現者。據估計核基因組編碼的蛋白質中30%左右的為膜蛋白。根據膜蛋白與脂分子的結合方式,可分為整合蛋白(integralprotein)、外周蛋白(peripheralprotein)和脂錨定蛋白(lipid-anchoredprotein)。
分類
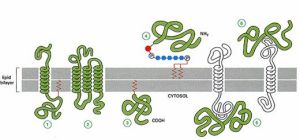 蛋白與膜的結合方式
蛋白與膜的結合方式根據蛋白分離的難易及在膜中分布的位置,膜蛋白基本可分為兩大類:外在膜蛋白(extrinsic protein)和內在膜蛋白或整合蛋白(intrinsic protein或integral protein)。外在膜蛋白約占膜蛋白的20%~30%,分布在膜的內外表面,主要在內表面,為水溶性蛋白,它通過離子鍵、氫鍵與膜脂分子的極性頭部相結合,或通過與內在蛋白的相互作用,間接與膜結合;內在蛋白約占膜蛋白的70%~80%,是雙親媒性分子,可不同程度的嵌入脂雙層分子中。有的貫穿整個脂雙層,兩端暴露於膜的內外表面,這種類型的膜蛋白又稱跨膜蛋白。內在膜蛋白露出膜外的部分含較多的極性胺基酸,屬親水性,與磷脂分子的親水頭部鄰近;嵌入脂雙層內部的膜蛋白由一些非極性的胺基酸組成,與脂質分子的疏水尾部相互結合,因此與膜結合非常緊密。
脂錨定蛋白(lipid-anchoredprotein)可以分為兩類,一類是糖磷脂醯肌醇(glycophosphatidylinositol,GPI)連線的蛋白,GPI位於細胞膜的外小葉,用磷脂酶C(能識別含肌醇的磷脂)處理細胞,能釋放出結合的蛋白。許多細胞表面的受體、酶、細胞粘附分子和引起羊瘙癢病的PrPC都是這類蛋白。另一類脂錨定蛋白與插入質膜內小葉的長碳氫鏈結合,如三聚體GTP結合調節蛋白(trimericGTP-bindingregulatoryprotein)的α和γ亞基。
功能
膜蛋白的功能是多方面的。有些膜蛋白可作為“載體”而將物質轉運進出細胞。有些膜蛋白是激素或其他化學物質的專一受體,如甲狀腺細胞上有接受來自腦垂體的促甲狀腺素的受體。膜表面還有各種酶,使專一的化學反應能在膜上進行,如內質網膜上的能催化磷脂的合成等。細胞的識別功能也決定於膜表面的蛋白質。這些蛋白常常是表面抗原。表面抗原能和特異的抗體結合,如人細胞表面有一種蛋白質抗原HLA,是一種變化極多的二聚體。不同的人有不同的HLA分子,器官移植時,被植入的器官常常被排斥,這就是因為植入細胞的HLA分子不為受體所接受之故。
總結一下,膜蛋白的功能有1)轉運體;2)酶;3)接收識別信號;4)連線結構
移動證明
很多膜蛋白在脂雙層中能夠自由移動,這可通過人、鼠兩種細胞的融合後,再用其中一種細胞的抗體,比如小鼠細胞的抗體,以螢光染料染色,而後將這種帶有螢光的抗體放入融合細胞的外面介質中,抗體就會和小鼠細胞的表面抗原結合。結果小鼠細胞表面也有了螢光,而人細胞由於不合小鼠抗體結合,就沒有螢光。這樣就可以在螢光顯微鏡下分清兩種細胞的表面抗原了。實驗結果表明,細胞開始融合時,人、鼠細胞的表面抗原“涇渭分明”,各自只分布於各自的細胞表面;但在融合之後,兩種抗原就逐漸平均分布在融合細胞的表面了。這一實驗說明膜蛋白是可移動的,也證明了膜的流動性。
但並不是一切膜蛋白都能在膜中移動,有些膜蛋白是不能移動或不能自由移動的。