發病原因
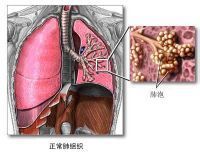 肺泡
肺泡臨床上導致ARDS的病因多達100多種。常見病因有休克、創傷、嚴重感染、誤吸、吸入有害氣體,輸液過量、DIC、病毒性肺炎、脂肪栓塞等。綜合文獻報導,將ARDS病因歸納為下列10類。
1.休克感染性、出血性、心源性。
2.創傷肺部或胸外創傷、肺脂肪栓塞、淹溺。
3.嚴重感染與膿毒血症細菌性肺炎、病毒性肺炎、真菌感染與真菌性肺炎、立克次體感染、結核、其他感染。
4.誤吸胃內容物。
5.吸入有害氣體高濃度氧、其他。
6.藥物麻醉藥物過量、美沙酮、秋水仙鹼、其他。
7.代謝性疾病糖尿病酸中毒。
8.血液疾病多次大量輸血、DIC。
9.婦產科疾病子癇及子癇前期、羊水栓塞。
10.其他急性胰腺炎、結締組織病、體外循環、心律轉復後、器官移植
發病機制
ARDS的發病機制錯綜複雜,目前雖有了深入的了解,但仍未完全闡明。多種效應細胞和炎症介質兩個主要因素參與了肺損傷,對ARDS發病機制起關鍵性作用。
1.參與反應的細胞
(1)多形核白細胞(PMNs):正常情況下肺間質內PMNs占1.6%。在ARDS早期,激活的補體C5a、細菌、免疫複合物等均能激活PMNs。其釋放氧自由基(oxygen radicals,OR)較多,對ARDS的發生與發展影響最大,不論任何原因引起的ARDS,被激活了的PMNs成為致病源,首先直接損傷肺組織,隨後在肺內出現各種炎症細胞,釋放多種炎症介質,加重肺損傷。
(2)上皮細胞和內皮細胞:有害氣體吸入後首先損傷肺泡上皮細胞。肺泡上皮細胞損傷後,細胞屏障作用被破壞,模孔增大,原具有屏障作用的細胞脂層被剝脫,其通透性增加。當內皮毒素等有害物質進入血液循環後,首先損傷肺泡毛細血管內皮細胞(pulmonarycpillaryendothelialcells,PCEC),使內皮細胞單層(monolayer)滲透性增加,收縮、死亡。內皮損傷2h後可出現肺間質水腫,嚴重損傷12~24h後才出現肺泡水腫。內皮細胞損傷後產生血栓素A2(thromboxaneA2)、血小板活化因子(plateletactivatingfactor,PAF)和白介素(LTS)可趨化更多的PMNs和血小板進入肺組織。
(3)單核-巨噬細胞(AM)系統:近來研究發現,在病理情況下,AM不僅參與ARDS的發病過程,而且還證明肺血管內巨噬細胞(pulmonaryintravascularmacrophage,PIM)也能產生OR,釋放溶酶體酶,前列腺素(PG),內毒素酯多糖(LPS)等,在介導肺微血管損傷和肺部炎症反應中起一定作用。
2.參與急性肺損傷的介質
(1)氧自由基:OR是重要的炎性介質之一,它可使PMN向炎症區遊走、聚集、激活並釋放溶酶體酶,損傷血管內皮,引起血管通透性增加。動物實驗發現OR在致傷後產生增加。OR來源於激活的PMN.AM.內皮細胞等,可破壞組織、細胞及蛋白質,使靜止態酶激活,破壞抗胰蛋白酶(a-AT),並影響花生四烯酸(AA)的代謝,使前列腺素(PGS)、血栓素(TXA2)、白介素(LTS)產生增加。
(2)花生四烯酸代謝產物(AA):在ARDS發病過程中AA的激活起很重要作用。
實驗證明,在低氧條件下測定RDS犬外周血PMN及AM產生白細胞三烯B4(LTB4)的變化,發現致傷後6hLTB4濃度顯著高於傷前及對照組。可見PMN和LTB4是顯著增加的。LTB4具有化學激動作用和趨化作用,可增加血管通透性,收縮支氣管平滑肌,引起支氣管黏膜水腫,減慢其纖毛運動及促進PMN釋放OR。因此,LTS對ARDS的發病起重要作用。
(3)補體系統:ARDS發病早期,首先補體系統被激活,其中間或終末產物是發病的重要調節介質。總補體(totalhemolyticcomplementactivity,CH50)明顯降低,中性白細胞聚集活性(neutrophilaggregationactivity,NAA)升高,引起PMN在肺內聚集,迅速出現呼吸窘迫。說明補體系統激活和PMN在肺內聚集,與ARDS的發病密切相關。
(4)酶系統被激活:蛋白溶解酶,膠原酶和組織蛋白酶均存在於PMN中,釋放後損傷肺泡毛細血管膜(ACM)的基底膜,內皮膠原和結構蛋白,導致ACM通透性增加,導致肺水腫。
(5)遞質:ARDS發病過程中釋放各種遞質,造成肺損傷。
①腫瘤壞死因子(TNF)是一種巨噬細胞產生的蛋白質。實驗證明內毒素損傷2h後即可測得TNF高峰,TNF直接注射常可引起低血壓休克,數小時死亡。激活PMN趨化作用,吞噬作用及釋放溶酶體酶和OR及促凝而損傷肺。
②白介素(TLS),其中IL-1與TNF均由單核細胞或巨噬細胞、內皮細胞等分泌。IL-1首先侵襲肺部,並可趣化PMN激活之,促進OR釋放,損害肺內皮細胞,使PMN黏附於內皮上,激活凝血及纖溶反應;促進合成與釋放兒茶酚胺(CA)及急性反應蛋白(ARC),啟動ARDS體液反應鏈,導致肺水腫、出血等。
③血小板活化因子(PAF)。PAF可由PL、PMN、AM、淋巴細胞、內皮細胞等產生,其靶細胞包括PL、AM及內皮細胞等,在休克發病中起重要作用。可通過PGS、LTS介質、損害肺組織,可導致循環血中PMN、PL激活並聚集於肺,釋放介質,使ACM通透性增加。
(6)肺表面活性物質(PS):PS為肺泡Ⅱ型上皮細胞(PC-Ⅱ)板層體(lamellarbodies)內合成,它與載體蛋白結合成脂蛋白後,分泌到肺泡腔內,形成薄層,構成氣液界面。PS的主要功能:①降低氣液界面的表面張力,防止肺泡萎陷;②保持適當的肺順應性,減少呼吸功;③防止肺微血管內液滲入肺泡,減少肺水腫發生;④增強肺防禦能力;⑤PS能抑制AM氧化爆發,防止大量OR的發生。
肺表面活性物質對於維持肺泡穩定起重要作用。ARDS患者因PC-Ⅱ損傷,PS合成減少或消耗過多,活性降低,滅活快等,使PS失去正常功能。可導致肺泡陷閉,大量血漿滲入肺泡內,出現肺泡水腫和透明膜形成。
3.滲透性肺水腫因上述多種機制導致肺泡毛細血管受損,毛細血管通透性增高,使較多的體液及血漿漏入到肺間質及肺泡腔,產生滲透性肺水腫。
4.PS減少導致肺泡萎陷,肺不張由於缺氧,酸中毒及一些毒性物質可損傷PC-Ⅱ,抑制PS的代謝,吸入高濃度氧和機械通氣,嚴重感染,以及肺血流灌注不足,肺毛細血管栓塞等,使肺泡上皮Ⅱ型細胞的磷脂代謝障礙影響PS的合成等,相互促進肺萎陷的惡性循環是呼吸窘迫的病理生理變化之一。
5.肺內分流增加,肺順應性下降,肺功能受損由於ARDS患者PS減少或活性降低,以及肺泡水腫,致肺泡不張,使肺泡處於通氣不足狀態,造成嚴重通氣血流比例失調,使肺泡毛細血管的血得不到充分氧合,導致部分混合靜脈血返回左心,形成分流。由於PS減少,肺間質及肺泡水腫,致肺泡不張,肺順應性下降,其通氣/血流比例下降,肺彌散功能障礙。
6.大體觀察肺呈明顯的飽滿腫脹,含氣減少,肺臟表面常見點灶狀出血,重量明顯增加,一般可增加3~4倍。肺切面有明顯的充血、出血、水腫或肺不張。
7.光學顯微鏡下改變
(1)肺間質及肺泡水腫、出血:首先出現肺間質水腫,後出現肺泡水腫。水腫明顯者形成小支氣管或小血管周圍套狀水腫或出血。
(2)灶狀肺不張:屍檢病例大多數可見局灶性肺不張。
(3)透明膜形成:透明膜常在明顯滲出基礎上發生,表現為較深紅色的均一的膜狀物,緊貼於肺泡,肺泡管及呼吸細支氣管壁上,呈環狀或半環狀或片帶狀,透明膜是ARDS典型病變之一。
(4)肺內瀰漫性炎性細胞浸潤:有時在發病早期既有PMN浸潤,但多在48h才能觀察到。3~4天后還可見到間質性肺炎,5天后幾乎100%繼發肺部感染性炎症。
(5)肺間質及終末氣道的纖維化:較早期可見到瀰漫性肺間質膠原纖維增生,晚期病例可見到明顯纖維化,肺滲出物及透明膜的機化或纖維化在病程3天以上可見到,7天以上明顯纖維化。故稱為急性肺纖維化。嚴重影響肺功能,晚期可出現大片纖維化,晚期肺可呈蜂窩肺。
病理改變
 老年人急性呼吸窘迫綜合徵
老年人急性呼吸窘迫綜合徵 各種病因所致的ARDS病理變化基本相同,可以分為滲出、增生和纖維化三個相互關聯和部分重疊的階段。
滲出期
見於發病後第一周。肺呈暗紅或暗紫的肝樣變,可見水腫、出血。重量明顯增加。24小時內鏡檢見肺微血管充血、出血、微血栓,肺間質和肺泡內有蛋白質水腫液及炎症細胞浸潤。若為感性病因引起者,肺泡腔PMNs聚集和浸潤更為明顯。72小時後由血漿蛋白凝結、細胞碎化、纖維素形成透明膜,灶性或大片肺泡萎陷不張。在急性滲出期Ⅰ型細胞受損壞死。
增生期
損傷後1~3周,肺Ⅱ型上皮細胞增生覆蓋剝落的基底膜,肺泡囊和肺泡管可見纖維化,肌性小動脈出現纖維細胞性內膜增生,導致血管腔截面積減少。
纖維化期
生存超過3~4周的ARDS患者肺泡隔和氣腔壁廣泛增厚,散在分隔的膠原結締組織增生致瀰漫性不規則纖維化。肺血管床發生廣泛管壁纖維增厚,動脈變形扭曲,肺行血管擴張。即使非感染性病因引起的ARDS,在後期亦不避免地合併肺部感染,常見有組織壞死和微小膿腫。
症狀
ARDS往往由於嚴重創傷、休克、敗血症、誤吸、有毒氣體吸入以嚴重感染等原發病所並發,其特點起病急、甚至突然發病。
1.呼吸困難呼吸頻數、呼吸窘迫是ARDS的主要臨床表現。通常在起病1~2天內發生呼吸頻數,進行性增快,往往超過28次/min,危重者呼吸頻率達60次/min,呼吸困難極為明顯,呈現呼吸窘迫症狀。
2.咳嗽、咳痰、煩躁和神志恍惚咳痰,咳出血樣痰是ARDS典型症狀之一。因缺氧、呼吸窘迫多數ARDS患者早期既開始出現煩躁、神志恍惚或表情淡漠。
3.體徵呼吸頻率快,隨著症狀加重,出現發紺、吸氣“三凹征”,部分病人肺部可聞及乾濕性囉音。
典型的ARDS臨床經過可分為4期:第一期,又稱急性損傷期,為潛伏期,主要為原發病的臨床表現;第二期,又稱穩定期,在發病24~48h以後,呼吸頻率增快,肺部可聞及濕性囉音,Pao2下降;第三期,急性呼吸衰竭期,病情發展迅速。呼吸困難加重,呼吸窘迫。PaO2進行性下降,給氧難以糾正,胸片出現典型的瀰漫性霧狀浸潤陰影;第四期,嚴重缺氧和二氧化碳瀦留,最後導致心衰、休克、昏迷、嚴重低氧導致死亡。
ARDS原發病多達100多種,發病機制錯綜複雜,目前臨床診斷主要依據病史,臨床表現和動脈血氣分析進行綜和判斷,尚無統一的診斷標準。但由於ARDS的臨床經過隱匿,加之ARDS的病死率高達50%,故早期診斷十分重要。
輔助檢查
肺功能測定
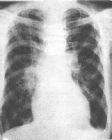 x線胸片
x線胸片1.肺量計測定肺容量和肺活量,殘氣,功能殘氣均減少。呼吸死腔增加,若死腔量/潮氣量(VD/VT)>0.6,提示需機械通氣。
2.肺順應性測定:在床旁測定的常為胸肺總順應性,套用呼氣末正壓通氣的患者,可按下述公式計算動態順應性(Cdyn)順應性檢測不僅對診斷、判斷療效,而且對監測有無氣胸或肺不張等合併症均有實用價值。
Cdyn=潮氣量
最大氣道內壓-呼氣末正壓
3.動脈血氣分析PaO2降低,是ARDS診斷和監測的常用指標。根據動脈血氧分析可以計算出肺泡動脈氧分壓差(PA-aO2)、靜動脈血分流(Qs/Qt)、呼吸指數(PA-aO2/PaO2),氧合指數(PaO2/FiO2)等派生指標,對診斷和評價病情嚴重程度十分有幫助。如Qs/Qt增被提倡用於病情分級,以高於15%,25%和35%分別劃分為輕、中、重不同嚴重程度。呼吸指數參照範圍0.1~0.37,>1表明氧合功能明顯減退。>2常需機械通氣。氧合指數參照範圍為53.2~66.7kPa(400~500mmHg),ARDS時降至26.7kPa(200mmHg)。
肺血管通透性和血流動力學測定
1.肺水腫液蛋白質測定ARDS時,肺毛細血管通透性增加,水分和大分子蛋白質進入間質或肺泡,使水腫液蛋白質含量與血漿蛋白含量之比增加,若比值>0.7,考慮ARDS,<0.5為心源性肺水腫。
2.肺泡-毛細血管膜通透性(ACMP)測定套用雙核素體內標記技術,以113銦(113In)自體標記轉鐵蛋白,用以測定肺的蛋白質積聚量,同時以99m鎝(99mTc)自體標記紅細胞,校正胸內血流分布的影響。分別算出113銦、99m鎝的肺心放射計數比值,觀察2小時的變化得出血漿蛋白積聚指數。健康人參考值為0.138×10-3/min。
3.血流動力學監測通過通入四腔漂浮導管,可同時測定並計算肺動脈壓(PAP)、肺動脈毛細血管楔壓(PCWP)、肺循環阻力(PVR)、PVO2、CVO2、Qs/Qt及熱稀法測定心輸出量(CO)等,不僅對診斷、鑑別診斷有價值,而且對機械通氣治療,特別是PEEP對循環功能影響,亦為重要的監測指標。ARDS患者平均脈動脈壓增高>2.67kPa,肺動脈壓與肺毛細血管楔壓差(PAP-PCWP)增加(>0.67kPa),PCWP一般<1.18kPa(12cmH2O),若>1.57kPa(16cmH2O),則為急性左心衰竭,可排除ARDS。
4.肺血管外含水量測定目前用染料雙示蹤稀釋法測定,由中心靜脈或右心導管管注入5cm靛氰綠染料葡萄糖液10ml,然後在股動脈通過與熱敏電阻連線的導管記錄熱稀釋曲線,並用密度計檢測染料稀釋曲線,再通過微機處理計算肺水量,可用來判斷肺水腫的程度,轉歸和療效,但需一定設備條件。
診斷
至今由於缺乏特異的檢測指標,給早期早期帶來困難。凡有可能引起ARDS的各種基礎疾病或誘因,一旦出現呼吸改變或血氣異常,均應警惕有本徵發生的可能。建立診斷綜合臨床、實驗室及輔助檢查,必要的動態隨訪觀察,並排除類似表現的其他疾病。為疾病統計和科研需要,必須依據確定的診斷標準。歷年來曾有各家提出的各種診斷標準,差別甚大。歐美學者在1992年分別在美國和歐洲的學術會議上商討、1992年同提出、並在1994年各種雜誌發表的關於ALI和ARDS定義和診斷標準,最近在我國被廣泛介紹和推薦。
ARDS診斷標準
除規定PaO/FiO≤26.7kPa(200mmHg)外,其餘指標與ALI相同。
1995年全國危重急救學學術會議(廬山)仿照上述標準提出我國ARDS分期診斷標準如下:
1.有誘發ARDS的原發病因。
2.先兆期ARDS的診斷應具備下述5項中的三項:⑴呼吸頻率20~25次/分。⑵(FiO20.21)PaO2≤9.31kPa(≤70mmHg),>7.8kPa(60mmHg)⑶PaO2/FiO2≥39.9kPa(≥300mmHg)⑷PA-aO2(FiO20.21)3.32~6.65kPa(25~50mmHg)⑸胸片正常。
3.早期ARDS的診斷應具備6項中3項。⑴呼吸頻率>28次/分。⑵(FiO20.21)PaO2≤7.90kPa(60mmHg)>6.60kPa(50mmHg)⑶PaCO2<4.65kPa(35mmHg)⑷PaO2/FiO2≤39.90kPa(≤300mmHg)>26.60kPa(>200mmHg)⑸(FiO21.0)PA-aO2>13.30kPa(>100mmHg)<26.60kPa(<200mmHg)⑹胸片示肺泡無實變或實變≤1/2肺野。
4.晚期ARDS的診斷應具備下述6項中3項:⑴呼吸窘迫,頻率>28次/分。⑵(FiO20.21)PaO2≤6.60kPa(≤50mmHg)⑶PaCO2>5.98kPa(>45mmHg)⑷PaO2/FiO2≤26.6kPa(≤200mmHg)⑸(FiO21.0)PA-aO2>26.6kPa(>200mmHg)⑹胸片示肺泡實變≥1/2肺野。
中華醫學會呼吸病學分會1999年制定的診斷標準如下:
1、有ALI/ARDS的高危因素。
2、急性起病、呼吸頻數和(或)呼吸窘迫。
3、低氧血症:ALI時動脈血氧分壓(PaO2)/吸入氧分數值(FiO2)≤300mmHg;ARDS時PaO2/FiO2≤200mmHg;
4、胸部X線檢查顯示兩肺浸潤陰影。
5、PAWP≤18mmHg,或臨床上能除外心源性肺水腫。
同時符合以上5項條件者,可以診斷ALI或ARDS
鑑別檢查
1.心源性肺水腫常見於高血壓、冠心病、主動脈瓣病變、心肌炎、風心病等引起的左心衰竭,結合病史、體徵、心電圖以及糾正心衰的治療,一般容易鑑別。
2.急性肺栓塞手術、創傷、長期臥床史、本病起病急,以及呼吸困難、胸痛、咯血、發紺、休克等為主要臨床表現。胸片顯示典型的圓形或三角形陰影。
3.瀰漫性肺間質纖維化本病多呈慢性經過,少數呈亞急性。本病肺部常持續存在爆裂性濕性囉音,胸片可見肺部網狀結節狀影,肺功能為限制性通氣障礙。
治療措施
ARDS治療的關鍵在於原發病及其病因,如處理好創傷,遲早找到感染灶,針對病的菌套用敏感的抗生素,制止炎症反應進一步對肺的損作;更緊迫的是要及時糾正患者嚴重缺氧,贏得治療基礎疾病的寶貴時間。在呼吸支持治療中,要防止擬壓傷,呼吸道繼發感染和氧中毒等併發症的發生。根據肺損傷的發病機制,探索新的藥理治療也是研究的重要方向。
呼吸支持治療
1.氧療糾正缺氧刻不容緩,可採用經面罩持續氣道正壓(CPAP)吸氧,但大多需要藉助機械通氣吸入氧氣。一般認為FiO2>0.6,PaO2仍<8kPa(60mmHg),SaO2<90%時,應對患者採用咱氣末正壓通氣PEEP為主的綜合治療。
2.機械通氣
⑴呼氣末正壓通氣(PEEP)1969年Ashbaugh首先報導使用PEEP治療5例ARDS患者,3例存活。經多年的臨床實踐,已將PEEP作為搶救ARDS的重要措施。PEEP改善ARDS的呼吸功能,主要通過其吸氣末正壓使陷閉的支氣管和閉合的肺泡張開,提高功能殘氣(FRC)。
PEEP為0.49kPa(5cmH2O)時,FRC可增加500ml。隨著陷閉的肺泡復張,肺內靜動血分流降低,通氣/血流比例和彌散功能亦得到改善,並對肺血管外水腫分嘏產生有利影響,提高肺順應性,降低呼吸功。PaO2和SaO2隨PEEP的增加不斷提高,在心排出量不受影響下,則全身氧運輸量增加。經動物實驗證明,PEEP從零增至0.98kPa(10cmH2O),肺泡直徑成正比例增加,而胸腔壓力變化不大,當PEEP>0.98kPa,肺泡直徑變化趨小,PEEP>1.47kPa(15cmH2O),肺泡容量很少增加,反使胸腔壓力隨肺泡壓增加而增加,影響靜脈血回流,尤其在血容量不足,血管收縮調節功能差的情況下,將會減少心輸出量,所以過高的PEEP雖能提高PaO2和SaO2,往往因心輸出量減少,反而影響組織供氧。過高PEEP亦會增加所胸和縱膈氧腫的發生率。最佳PEEP應是SaO2達90%以上,而FiO2降到安全限度的PEEP水平〔一般為1.47kPa(15cmH2O)〕。患者在維持有效血容量、保證組織灌注條件下,PEEP宜人低水平0.29~0.49kPa(3~5cmH2O)開始,逐漸增加至最適PEEP,如PEEP>1.47kPa(15cmH2O)、SaO2<90%時,可能短期內(不超過6h為宜)增加FiO2,使SaO2達90%以上。應當進一步尋找低氧血症難以糾正的原因加以克服。當病情穩定後,逐步降低FiO2至50%以下,然後再降PEEP至≤0.49kPa(5cmH2O),以鞏固療效。
⑵反比通氣(IRV)即機械通氣呼(I)與呼(E)的時間比≥1:1。延長正壓吸氣時間,有利氣體進入阻塞所致時間常數較長的肺泡使之復張,恢復換氣,並使快速充氣的肺泡發生通氣再分布,進入通氣較慢的肺泡,改善氣體分布、通氣與血流之比,增加彌散面積;縮短呼氣時間,使肺泡容積保持在小氣道閉合的肺泡容積之上,具有類似PEEP的作用;IRV可降低氣道峰壓的PEEP,升高氣道平均壓(MAP),並使PaO2/FiO2隨MAP的增加而增加。同樣延長吸氣末的停頓時間有利血紅蛋白的氧合。所以當ARDS患者在PEEP療效差時,可加試IRV。要注意MAP過高仍有發生氣壓傷和影響循環功能、減少心輸出量的副作用,故MAP以上不超過1.37kPa(14cmH2O)為宜。套用IRV,時,患者感覺不適難受,可加用鎮靜或麻醉劑。
⑶機械通氣併發症的防治機械氣本身最常見和致命性的併發症為氣壓傷。由於ARDS廣泛炎症、充血水腫、肺泡萎陷,機械通氣往往需要較高吸氣峰壓,加上高水平PEEP,增加MAP將會使病變較輕、順應性較高的肺單位過度膨脹,肺泡破裂。據報告當PEEP>2.45kPa(25cmH2O),並發氣胸和縱隔氣腫的發生率達14%,病死率幾乎為100%。現在一些學者主張低潮氣量、低通氣量,甚至允許有一定通氣不足和輕度的二氧化碳瀦留,使吸氣峰壓(PIP)<3.92kPa(40cmH2O)<1.47kPa(15cmH2O),必要時用壓力調節容積控制(PRVCV)或壓力控制反比通氣壓力調節容積控制〔PIP,<2.94~3.43kPa(30~35cmH2O)〕。因外也有採用吸入一氧化氮(NO)、R氧合膜肺或高頻通氣,可減少或防止機械通氣的氣壓傷。
3.膜式氧合器ARDS經人工氣道機械通氣、氧療效果差,呼吸功能在短期內又無法糾正的場合下,有人套用體外膜肺模式,經雙側大隱靜脈根啊用擴張管擴張扣分別插入導管深達下腔靜脈。現發展了血管內氧合器/排除CO2裝置(IVOX),以具有氧合和CO2排除功能的中空纖維膜經導管從股靜脈插至下腔靜脈,用一負壓吸引使氮通過IVOX,能改善氣體交換。配合機械通氣可以降低機械通氣治療的一此參數,減少機械通氣併發症。
維持適宜的血容量
創傷出血過多,必須輸血。輸血切忌過量,滴速不宜過快,最好輸入新鮮血。庫存1周以上血液含微型顆粒,可引起微栓塞,損害肺毛細血管內皮細胞,必須加用微過濾器。在保證血容量、穩定血壓前提下,要求出入液量輕度負平衡(-500~-1000ml/d)。為促進水腫液的消退可使用呋噻米(速尿),每日40~60mg。在內皮細胞通透性增加時,膠體可滲至間質內,加重肺水腫,故在ARDS的早期不宜給膠體液。若有血清蛋白濃度低則當別論。
腎上腺皮質激素的套用
它有保護毛細血管內皮細胞、防止白細胞、血小板聚集和粘附管壁形成微血栓;穩定溶酶體膜,降低補體活性,抑制細胞膜上磷脂代謝,減少花生四烯酸的合成,阻止前列腺素及血栓素A2的生命;保護肺Ⅱ型細胞分泌表面活性物質;具抗炎和促使肺間質液吸收;緩解支氣管痙攣;抑制後期肺纖維化作用。目前認為對刺激性氣體吸入、外傷骨折所致的脂肪栓塞等非感染性引起的ARDS,早期可以套用激素。地塞米松60~80mg/d,或氫化考的松1000~2000mg/d,每6h1次,連用2天,有效者繼續使用1~2天停藥,無效者遲早停用。ARDS伴有敗血下或嚴重呼吸道感染忌用激素。
糾正酸鹼和電解質紊亂
與呼吸衰竭時的一般原則相同。重在預防。
營養支持
ARDS患者處於高代謝狀態,應及時補補充熱量和高蛋白、高脂肪營養物質。應儘早給予強有力的營養支持,鼻飼或靜脈補給,保持總熱量攝取83.7~167.4kJ(20~40kCal/kg)。
其他治療探索
1.肺表面活性物質替代療法目前國內外有自然提取和人工製劑的表面活性物質,治療嬰兒呼吸窘迫綜合徵有較好效果,外源性表面活性物質在ARDS僅暫時使PaO2升高。
2.吸NONO即血管內皮細胞衍生舒張因子,具有廣泛生理學活性,參與許多疾病的病理生理過程。在ARDS中的生理學作用和可能的臨床套用前景已有廣泛研究。一般認為NO進入通氣較好的肺組織,擴張該區肺血管,使通氣與血流比例低的血流向擴張的血管,改善通氣與血流之比,降低肺內分流,以降低吸氧濃度。另外NO能降低肺動脈壓和肺血管阻力,而不影響體循環血管擴張和心輸出量。有學者報導,將吸入NO與靜脈套用阿米脫林甲醯酸(almitrinebismyslate)聯合套用,對改善氣體交換和降低平均肺動脈壓升高有協同作用。後者能使通氣不良的肺區血管收縮,血流向通氣較好的肺區;並能刺激周圍化學感受器,增強呼吸驅動,增加通氣;其可能產生的肺動脈壓升高可被NO所抵消。目前NO套用於臨床尚待深入研究,並有許多具體操作問題需要解決。
3.氧自由基清除劑、抗氧化劑以及免疫治療根據ARDS發病機制,針對發病主要環節,研究相應的藥物給予干預,減輕肺和其它臟器損害,是目前研究熱點之一。
過氧化物岐化酶(SOD)、過氧化氫酶(CAT),可防止O2和H2O2氧化作用所引起的急性肺損傷;尿酸可抑制O2、OH的產生和PMNs呼吸暴發;維生素E具有一定抗氧化劑效能,但會增加醫院內感染的危險。
脂氧化酶和環氧化酶途徑抑制劑,如布洛芬等可使血栓素A2和前列腺素減少,抑制補體與PMNs結合,防止PMNs在肺內聚集。
免疫治療是通過中和致病因子,對抗炎性介質和抑制效應細胞來治療ARDS。目前研究較多的有抗內毒素抗體,抗TNF、IL-1、IL-6、IL-8,以及抗細胞黏附分子的抗體或藥物。
併發症
急性呼吸窘迫綜合徵患者病後不久,數天或數周后病情未得緩解時,可由於氧供不足引起出現其他器官引發心肌病
的併發症。缺氧時間過長可引起嚴重的併發症如腎功能衰竭,如未獲及時治療,可因嚴重缺氧而死亡。由於急性呼吸窘迫綜合徵患者防禦肺部感染的能力低下,在其患病過程中常常出現細菌性肺炎。
預防
對高危的患者應嚴密觀察,加強監護,一但發現呼吸頻速,PaO2降低等肺損傷表現,在治療原發開門見山時,應早期給予呼吸支持和其它有效的預防及干預措施,防止ARDS進一步發展和重要臟器損傷。
護理
急性呼吸窘迫綜合徵(ARDS)是急性呼吸衰竭的一種類型。病人原來心肺功能正常,但由於肺外或肺內的原因引起急性滲透性肺水腫和進行性缺氧性呼吸衰竭。臨床表現為突發性、進行性呼吸窘迫,氣促、紫紺,常伴有煩躁、焦慮表情、出汗等。ARDS的治療包括改善換氣功能及氧療、糾正缺氧、及時去除病因、控制原發病等。常見護理問題有:①低效型呼吸型態;②氣體交換受損;③心輸血量減少;④潛在併發症--氣壓傷;⑤有皮膚完整性受損的危險;⑥有口腔黏膜改變的危險;⑦潛在併發症--水、電解質平衡紊亂;⑧焦慮。
預後
ARDS的預後極為嚴重,Roland報導數年前病死率為100%,目前仍為50%~60%。中國1988年病死率為51.6%,老年人ARDS病死率高達85.7%。其中藥物過量及骨折脂肪栓塞引起的ARDS預後較好。金黃葡萄球菌引起的ARDS預後亦較好。但腦外傷引起的ARDS病死率極高。預後與原發病是否容易處理有關。
