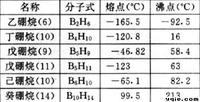
分子通式
單簇硼烷化合物可以用以下四種通式表示,其中n表示硼原子個數:
| 類型 | 分子式 | 備註 |
| closo− | BnHn | No neutral BnHn+2 boranes are known |
| nido− | BnHn+4 | |
| arachno− | BnHn+6 | |
| hypho− | BnHn+8 | only adducts established |
聚集類型
不同數目的硼原子和氫原子聚集形成不同類型的原子簇,原子的空間排布方式也不同,具體見下圖:
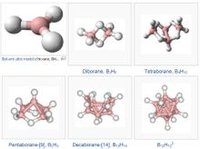 硼烷
硼烷理化性質
單的硼烷應該是BH3 ,但這一化合物不能單獨存在,只存在其衍生物,因此,硼烷中的第一個成員是B2H6。乙硼烷易溶於乙醚,其餘多數溶於苯。加熱時易分解成硼和氫氣,多數硼烷在空氣中能自燃,硼烷燃燒時放出大量的熱,所以可用作火箭的高能燃料,但這類物質毒性大,在一般條件下燃燒不完全。 簡單的硼烷無色,有難聞臭味,性質不穩定,有毒。硼烷分子中組成某些化學鍵的一對電子共享於3個原子之間,形成了三中心鍵(B—B—B鍵和B—H—B鍵)。可用鹵化硼與氫化鋁鋰的反應製取,主要用作噴氣飛機和火箭的高能燃料。
硼元素位於化學元素周期表第Ⅲ主族,原子最外層有三個電子,能與氫原子(或硼原子)形成三個共價鍵,具有較強的還原性,常用作還原試劑。形成三個共價鍵的硼原子最外層含為6個電子,並非八偶體結構,還有一個空軌道來接受孤對電子,比較容易與氮原子、氧原子、硫原子等含孤對電子對的原子形成配位鍵。市售的硼烷試劑如硼烷二甲硫醚、硼烷四氫呋喃、N,N-二乙基苯基硼烷等均是硼烷與其他實際形成配位鍵的形式保存。
硼烷的毒性很大:吸入乙硼烷會損害肺部;吸入癸硼烷會引起心力減退;水解較慢的硼烷易積聚而使中樞神經系統中毒,並會損害肝臟和腎臟。
乙硼烷燃燒:
B2H6+3O2=B203+3H2O
硼烷水解時放出大量的熱,如:
B2H6+6H2O=2B(OH)3↓+6H2↑
從上述的反應我們知道,硼烷類化合物遇水、遇氧氣極不穩定,容易失效,因此在硼烷化合物的儲存和運輸過程要在無水無氧條件下進行。
威智醫藥為全國最大的有機硼試劑生產廠商,擁有一支專業有機硼化合物研發團隊,從事有機硼化合物生產、運輸和使用工作達五年以上。公司提供的雙閥不鏽鋼鋼瓶包裝的有機硼化合物能最大限度地確保其在運輸和使用過程中的安全性和便利性。公司有機硼試劑如硼烷二甲硫醚、硼烷四氫呋喃年生產能力均在100噸以上。
文獻介紹
硼烷方程是日本化學家新村洋一在無機化學概論這本書中提到的。現摘錄如下:
若硼烷化學式為BpHp+q,且X是通常的2中心鍵個數減去P的差,S是橋式H個數,T是3個B形成的3中心鍵個數,Y是2中心B-B鍵,則:
S+X=q
S+T=p
T+Y=p-Q/2
氫化硼(BpHp+q+c)c+離子也能列出一個方程:
S+X=q+C
S+T=p
T+Y=p-(Q/2)-C
不包括BH4-