基本定義
當溶液中的離子濃度([Am+]m)的乘積等於溶度積(L)時,則溶液是飽和的;若小於其溶度積時,則沒有沉澱生成;若大於其溶度積時,會有AnBm化合物的沉澱析出。即可表示為: [Am+]·m<L時,溶液未飽和,無沉澱析出; [Am+]·m=L時,溶液達到飽和,仍無沉澱析出; [Am+]·m>L時,有Anbm沉澱析出,直到[Am+]·m=L時為止。
基本舉例
例:AgNO3與K2CrO4混合溶液,用溶度積規則來判斷時候有Ag2CrO4析出。
註:CrO4^2-表示一個鉻酸根離子帶兩個負電荷。
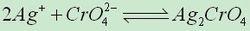 溶度積規則
溶度積規則令:[Ag+]^2·[CrO4^2-]=Qc (式中[ ]表示溶液中離子的實際的相對濃度)。
注意:此處的 Ag+ 與 CrO4^2- 的濃度時彼此獨立指定的,沒有必然聯繫,也沒有定量關係。
查表可得Ag2CrO4的溶度積常數Ksp。
Qc<Ksp時:溶液相對於Ag2CrO4晶體而言是未飽和的,故無Ag2CrO4晶體沉澱;
Qc=Ksp時:溶液相對於Ag2CrO4晶體而言剛好達到飽和,為多相離子平衡狀態,也無Ag2CrO4晶體沉澱;
Qc>Ksp時:溶液相對於Ag2CrO4晶體而言是過飽和的,有Ag2CrO4晶體沉澱。
實際上是平衡和平衡移動規則在多相離子平衡中的套用。
