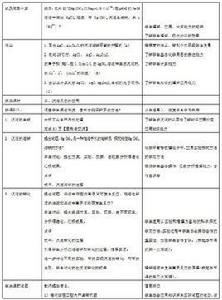
定義
在一定溫度下,難溶電解質晶體與溶解在溶液中的離子之間存在沉澱溶解和生成的平衡,稱為沉澱溶解平衡。將難溶電解質AgCI放入水中,固體表面的一部分Ag和Cl在水分子的不斷作用下脫離AgCl固體,與水分子締合成水合離子進入溶液,此過程稱作沉澱的溶解;與此同時,溶液中的水合Ag 和Cl 不斷運動,其中一部分受到AgCl固體的表面帶相反電荷的離子吸引,又會重新結合成固體AgCI,此過程稱作沉澱的生成。難溶電解質的溶解和生成是可逆過程。一段時間後,當難溶電解質溶解的速率和生成的速率相等,溶液中各離子的濃度不再發生變化,難溶電解質固體和溶液中水合離子間的沉澱溶解平衡由此建立:
AgCI(s)≒Ag (aq)+Cl (aq)
該反應的平衡常數表達式如下:
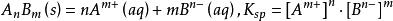 溶度積
溶度積詳細解釋
溶度積——K
事實證明,任何難溶的電解質在水中總是或多或少地溶解,絕對不溶解的物質是不存在的。通常把在100g水中的溶解度小於0.01g的物質稱為難溶物。難溶電解質在水中溶解的部分是完全離解的,即溶解多少,就離解多少。
例如,AgCl的離解平衡如下:
溶解達到平衡時的溶液叫飽和溶液。AgCl的溶度積:
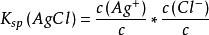 溶度積
溶度積式中各物質濃度均為溶解平衡時的濃度,固體濃度在表達式中不出現。c是標準濃度,一般定義為1mol/L,用於取消K的單位。
溶度積的大小反映了物質的溶解能力。它會受溫度的變化以及其他電解質的溶解影響而改變,所以通常給出的數值為某一單一電解質在特定溫度下測定的。
對於PbCl,Ca(PO)以及Mg(OH)等能解離出兩個或多個相同離子的難溶電解質,在書寫其表達式時,應如同寫平衡常數的方法一樣,各離子濃度取離解方程式中該離子的係數為指數:
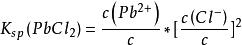 溶度積
溶度積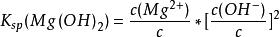 溶度積
溶度積它可由實驗測得,亦可由一些化學熱力學公式理論上推測。
溶度積(K)和溶解度(S)都可用來衡量某難溶物質的溶解能力,它們之間可以互相換算。
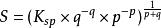 溶度積
溶度積若一電解質分子在溶解後生成p個陽離子,q個陰離子,則
溶度積規則
將Q的大小與K進行比較,根據化學平衡移動原理,可知:
當Q>K時,溶液為過飽和溶液,平衡往左移動,沉澱析出;
當Q<K時,溶液為不飽和溶液,若溶液中仍有沉澱存在,平衡往右移動,沉澱溶解;
當Q=K時,溶液為飽和溶液,處於沉澱溶解平衡狀態,既無沉澱生成,也無沉澱溶解。
上述規則,可以用來判斷沉澱生成和溶解的發生,稱為溶度積規則
例題講解
例5-5 已知 Ca(PO)的K為2.0×10 ,求:
(1) Ca(PO)在純水中的溶解度;
(2) Ca(PO)在0.10 mol·L NaPO溶液中的溶解度。
S=7.14×10
即 Ca(PO) 在純水中的溶解度為 7.14×10 mol·L 。
因為S很小,所以
2S+0.10≈0.10
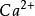 溶度積
溶度積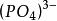 溶度積
溶度積=[c( )/c ] [c( )/c ]
=(3S) (2S+0.10)
≈(3S) (0.10) =2.0×10
S=4.2×10
即 Ca(PO)在0.10 mol·L NaPO溶液中溶解度為4.2×10 mol·L 。
與弱電解質的離解平衡一樣,難溶電解質的溶解平衡也受同離子效應的影響,結果平衡左移溶解度降低。又如:
AgCl(s) ≒ Ag (aq)+Cl (aq)
在AgCl(s)的飽和溶液中,加入NaCl或AgNO由於同離子效應,使AgCl(s)溶解度降低。