內容
根據科學技術數據委員會(CODATA)2010年的數據,玻爾半徑的值為5.2917721092(17)×10^-11 米(即約53皮米或0.53埃格斯特朗)。括弧內數字(18)代表最後數位的不確定度。
計算(當不計核的運動):
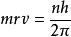 波爾半徑
波爾半徑①量子化條件
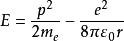 波爾半徑
波爾半徑②當不計核的運動,氫原子的能量就是電子的能量
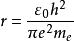 波爾半徑
波爾半徑由①② =52.9177pm
套用
儘管玻爾模型並沒有正確地描述原子,玻爾半徑還是保有了它的物理意義,代表著電子云大小的完全量子力學描述。因此玻爾半徑常被用於原子物理學。
要注意的是玻爾半徑並沒有包括約化質量的效應,所以在其他包括了約化質量的模型中,並不能準確地等於氫原子電子的軌道半徑。這是為了方便而設的:上述方程定義的玻爾半徑適用於氫原子以外的其他原子,而它們的約化質量修正值都不同。如果玻爾半徑包括了氫原子的約化質量,就有需要加入一個複雜的修正值來使方程適用於其他原子。

