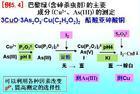
基本性質
氧化劑和還原劑的氧化還原能力可以用相關電對的電極電位(簡稱電位,elecrodepotential)來衡量。電對的電極電位越高,其氧化態的氧化能力越強;反之,電對的電極電位越低,其還原態的還原能力就越強。
此外,氧化還原反應進行的方向和次序取決於相關電對的電極電位大小,氧化劑與還原劑之間自發的反應,總是向著高電位電對中的氧化態物質氧化低電位電對中的還原態物質的方向進行;氧化還原反應進行的完全程度取決於相關電對的電極電位差。因此,電對的電極電位是討論物質的氧化還原性質的重要參數。
概念引出
氧化還原反應電對的電位可用能斯特(Nernst)方程式表示,即
Ox+ne →Red
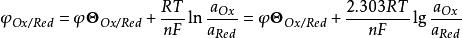 條件電位
條件電位式中:φ—Ox/Red電對的電位,簡寫為φ;
φ —Ox/Red電對的標準電位,簡寫為φ ;
R—氣體常數,8.314J·(K·mol) ;
T—熱力學溫度,273.15+t℃;
n—電極反應中的電子轉移數;
a、a—氧化態Ox、還原態Red的活度。
在25℃時,將以上各常數代入上式得(1)式:
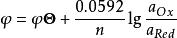 條件電位
條件電位實際工作中,通常知道的是反應物的濃度而非活度,故必須引入相應的活度係數。如果電對的氧化態及還原態還參與酸鹼、沉澱或配位等副反應,還必須引入副反應係數,即
a=γ[Ox]=γC/α
a=γ[Red]=γC/αRed
式中γ、α、[ ]、C分別為氧化態或還原態的活度係數、副反應係數、平衡濃度和分析濃度代入(1)式得:
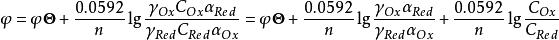 條件電位
條件電位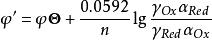 條件電位
條件電位式中φ’稱為 條件單位(conditional potential),它是在一定條件下,氧化態和還原態的分析濃度均為1mol·L 時,校正了各種外界因素影響後的實際電位。條件電位與標準電位不同,它的數值與溶液中電解質的種類和濃度,特別是能與電對發生副反應的物質的種類和濃度有關,只有在一定條件下才為一常數。當條件改變時,條件電位將隨之改變。例如,Fe /Fe 電對的標準電位φ =0.771V,而φ’則不同。
 Fe3+/Fe2+電對的條件電位
Fe3+/Fe2+電對的條件電位影響因素
凡是影響電對氧化態與還原態的活度係數和副反應係數的各種因素都會使條件電位的大小發生變化,這些因素主要包括離子強度、溶液酸度以及生成沉澱和生成配合物的副反應等。
離子強度的影響
溶液中的離子強度對條件電位的影響稱為鹽效應。溶液中電解質的濃度變化引起離子強度的改變,進而改變氧化態和還原態的活度係數,最終對氧化還原電對的條件電位產生影響。
在氧化還原反應中,電解質的濃度往往較高,溶液的離子強度較大,氧化態和還原態的價態大多也較高。故鹽效應比較顯著。但離子活度係數的精確值不易得到,因而離子強度的影響通常難以精確校正。同時,氧化還原體系中的各種副反應對條件電位的影響遠比離子強度的影響大,因此,在估算條件電位時,常忽略離子強度的影響,即近似地認為離子活度係數均為1。
溶液酸度的影響
溶液酸度對條件電位的影響(稱酸效應)包含兩個方面:
1、如果電對的半反應中有H或OH參加,條件電位的計算式中有H或OH的濃度,溶液酸度的變化將直接
影響相關電對的條件電位。
2、如果電對的氧化態或還原態是弱酸或弱鹼,其存在形式會受到溶液酸度的影響,溶液酸度的變化將間接引起條件電位的變化。
其他副反應的影響
除酸效應外,氧化還原滴定中常見的副反應有生成沉澱和生成配合物的反應。
1、生成沉澱
在氧化還原反應體系中,若有與電對的氧化態或還原態生成沉澱的沉澱劑存在,將會改變電對的條件電位。如果氧化態生成沉澱,條件電位將降低;如果還原態生成沉澱,條件電位將升高。
2、生成配合物
氧化還原電對中的金屬離子可與溶液中的某些配位劑發生配位反應,配合物的生成會影響電對的條件電位。如果氧化態的配合物比還原態的配合物穩定,條件電位降低;反之,條件電位升高。在氧化還原滴定中,常利用這一規律,通過加人可與干擾離子生成穩定配合物的配位劑來消除對測定的干擾。