概念
放射性藥物(radio pharmaceutical)又稱放射性藥品,是指用於臨床診斷或者治療的放射性核素製劑或者其標記化合物。是含有放射性核素供醫學診斷和治療用的特殊藥物。放射性藥品與其它藥品的不同之處在於,放射性藥品含有的放射性核素能放射出射線。因此,凡在分子內或製劑內含有放射性核素的藥品都稱為放射性藥品。
放射性藥物除外和一般藥物一樣必須符合藥典,如無菌、無熱源、化學毒性小等要求,還應根據診治需要而對其發射的核射線種類、能量和T1/2有一定要求。
管理原則
醫療單位設定核醫學科、室(同位素室),必須配備與其醫療任務相適應的並經核醫學技術培訓的技術人員。非核醫學專業技術人員未經培訓,不得從事放射性藥品使用工作。
分類
 PET
PET(一)診斷放射性藥物
核射線中以γ光子(能量以100~300keV為宜)穿透力強,引入體內後容易被核醫學探測儀器在體外探測到,從而適用於顯像;同時γ光子在組織內電離密度較低,從而機體所受電離輻射損傷較小,因此,診斷用放射性藥物多採用發射γ光子的核素及其標記物。
1.正電子發射斷層(PET)放射性藥物
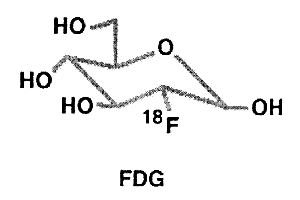
正電子放射性藥物11C、13N、15O和18F等短半衰期放射性核素(表1-2)在研究人體生理、生化、代謝、受體等方面顯示出獨特優勢,其中氟[18F]脫氧葡萄糖(18F-FDG)是目前臨床套用最為廣泛的正電子放射性藥物。PET是當前放射性藥物顯像技術中解析度和靈敏度最高的顯像裝置(2-4mm),它與生產正電子放射性核素的小型回旋加速器和自動化的放射化學合成儀三者相結合構成PET顯像中心。PET顯像所用的正電子核素有18F(氫類似物)、11C、13N、15O等,其中11C、13N、15O是組成人體生命的基本元素,這些標記化合物的代謝過程能真正反映機體生理、生化功能的變化,是生命科學研究領域的分子探針。不但可以有效地診斷癲癇、中風、腫瘤、早老性痴呆及精神分裂等疾病,還可觀察到腦中的由視覺、音響、情緒刺激等引起的神經活動,也可用來研究腦的學習、記憶等功能,這是將人的思維、行為與腦的化學反應相聯繫的一個重大突破。目前全世界已建立了300多台PET裝置,主要集中在美國、日本和西歐等國。我國現有十幾台PET裝置,並開始生產正電子放射性藥物。
當前,雖然CT和MRI等技術對人腦的解剖學形態和構造顯像取得了理想的進展,但是人腦的功能異常複雜。許多神經性和精神性疾病均會出現腦受體的變化,如帕金森病與多巴胺受體和多巴胺轉運蛋白有關,早老性痴呆症與毒蕈鹼樣乙醯膽鹼受體有關,早老性痴呆症、精神分裂症、抑鬱症等與5-羥色胺受體有關。而腦內受體數量極微,受體的分布、數量和密度出現變化均不能被目前的CT和MRI顯示,腦受體顯像劑則可在分子水平上展現腦內的生理、病理狀態,這是其他顯像方法所無法比擬的。例如,對於某些臨床症狀明顯的帕金森病病人,腦內已經存在生化、病理方面的改變,但CT、MRI檢查結果為陰性。若套用受體顯像劑對多巴胺受體顯像或多巴胺轉運蛋白顯像,則可顯示其病變部位。這就為測定病人腦在解剖結構發生改變之前出現的生理、生化及功能變化提供客觀依據,從而達到早期診斷與治療的目的。因此,受體顯像是神經核醫學的重點研究領域之一。
七十年代以來,隨著PET探測技術的不斷發展和套用,一系列由11C、18F等正電子核素標記的受體放射性藥物得到迅速發展,已用於多巴胺受體、乙醯膽鹼受體、5-羥色胺受體、阿片受體、腎上腺素受體等的定量測定。正電子核素腦放射性藥物目前正朝著腦內各類受體定量測定的方向發展,為在更高的層次上研究受體在開啟腦的神經功能方面所起的作用,這無疑會極大地加深人們對腦的神經中樞功能的認識。
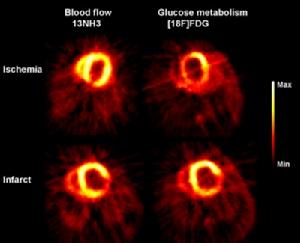
同時,PET放射性藥物也用於心臟病和腫瘤等疾病的診斷。例如利用13N-NH3或15O-H2O和18F-FDG先後觀察心肌血流與心肌葡萄糖攝取的方法可以判斷患者的心肌是否存活。如果前者的放射性攝取減低,而18F-FDG仍保持攝取,則表示心肌存活,應當及早考慮給病人進行冠狀動脈再造術(心臟搭橋手術);但是,如果血流下降的心肌的18F-FDG攝取也減低,則該節段的心肌為梗塞心肌;若灌注顯像劑的放射性明顯減低,而18F-FDG僅為輕度減低,則表示部分心肌存活。另外,由於快速增生的細胞具有很高的代謝率,特別是葡萄糖酵解速率,因此,腫瘤病灶與周圍正常組織相比,其葡萄糖利用率明顯增高,因此18F-FDG又是最常用的腫瘤顯像劑,
雖然PET可以三維、定量、動態地觀察放射性藥物在活體內的生理,生化過程,又有很高的探測靈敏度和空間解析度,但由於建立PET中心耗資巨大,從而限制了它的廣泛使用。另外,正電子核素除11C、13N、15O、18F等非金屬元素外,還包括55Co、60Cu、61Cu、62Cu、64Cu、66Ga、68Ga、82Rb和86Y等金屬元素。這類PET放射性藥物也用於腦、心臟、肺、腫瘤等疾病的診斷研究。值得一提的是,儘管放射性金屬標記的PET放射性藥物近十年來取得了較大的進展,但很難具有像11C、13N、15O等生命元素的性質,因此,它們的發展和套用前景也是有限的。
2.單光子發射斷層(SPECT)放射性藥物
99mTc、123I、67Ga、111In和201Tl等為單光子發射核素,它們由反應堆或加速器生產,並與SPECT顯像技術相匹配,雖然SPECT的解析度一般為8mm左右,但由於成本遠較PET低,並可以在分子水平上探測到人體重要器官的形態、功能和代謝,從而成為當前核醫學臨床診斷中使用最廣泛的手段。目前世界上有SPECT一萬多台,我國有300多台,其中,尤以99mTc為最佳單光子顯像核素。它具有優良的核性質和化學性質,如99mTc的半衰期為6.02小時,其單能g射線為140kev,這就使得病人所受的輻射劑量較小,且它在體內臟器和測量準直器中的穿透性也較宜。鎝具有從-1價到+7價的各種化學價態,可以設計出對腦、心、腫瘤、肝、脾、腎、骨、血栓、炎症等臟器和部位的顯像藥物。99Mo-99mTc發生器的研製成功,使99mTc的來源易得,價格便宜。99mTc放射性藥物製備的藥盒化或以“奶站”的方式(每天定時將製備好的經過質控的放射性藥物送到醫院,象送奶一樣,直接供醫院使用)供應,極大地簡化了醫院的臨床套用。所有這些優點,促使99mTc放射性藥物在全世界的用量約占整個放射性顯像藥物的80%-85%,它幾乎能對人體所有重要臟器進行顯像,目前重點圍繞腦、心臟和腫瘤三大疾病進行99mTc放射性藥物的研究和開發。限於時間關係,只能重點介紹99mTc放射性藥物在這三大疾病中的套用。
1.2.1鎝(99mTc)放射性藥物
(1)99mTc腦灌注顯像劑
早期的鎝腦放射性藥物,如99mTcO4-、99mTc-dtpa等只能通過已經損傷的血腦屏障進行腦疾病部位的陽性顯像,功能性腦顯像劑要求藥物能夠通過完整的血腦屏障進行腦功能的顯像。99mTc腦灌注顯像劑用於測定局部腦血流量,可對腦缺血性疾病、偏頭痛、腦外傷等疾病進行診斷,要求在腦中有確定的區域分布、較高的腦吸取量和較長的滯留時間等。目前,99mTc–d,l-HMPAO和99mTc-L,L-ECD已被美國食品和藥物管理委員會FDA通過用於臨床,99mTc-MRP20在歐洲也已用於臨床。值得一提的是,99mTc–d,l-HMPAO是第一個被FDA批准用於臨床的鎝腦放射性藥物,具有里程碑的意義。99mTc-L,L-ECD的滯留機制是酶解作用,僅在靈長類(猴類和人類)腦中發生。
此外,研製成功的還有鎝肟的硼酸加合物BATO類配合物,但由於它在腦中的滯留時間較短,在臨床上並未得到廣泛套用。最近,隨著TcN核製備方法的不斷改進,TcN核類配合物也用於腦灌注顯像劑研究,並且取得了很大進展,但目前還未被FDA批准用於臨床。
2、99mTc腦受體放射性顯像藥物
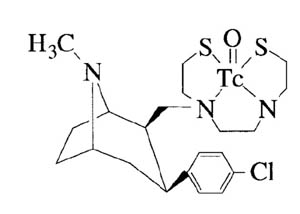
腦內各類受體的放射性藥物由於要穿透膜屏障和血腦屏障等要求,對於放射性配體的大小、電荷、脂溶性等因素均有嚴格的要求。而99mTc是一種金屬,要標記到小分子配體上而同時又不影響受體結合的各種特性就十分困難,儘管人們對99mTc標記的腦受體顯像藥物進行了大量艱苦的探索,但到目前為止,99mTc標記的腦受體顯像劑成功的例子只有一個:多巴胺轉運蛋白顯像劑99mTc-TRODAT-1。
多巴胺轉運蛋白是位於多巴胺神經元突觸前膜的一種糖蛋白,它選擇性地與突觸間隙的多巴胺神經遞質結合,將其運回突觸前膜,從而終止多巴胺的作用。99mTc-TRODAT-1對多巴胺轉運蛋白具有高的親和力,而且在腦內有較高的攝取值,在腦的紋狀體部位有很高的選擇性濃集。這是第一個成功用於人體顯像的多巴胺轉運蛋白顯像劑,目前正處於臨床試驗階段,有望對帕金森病等進行早期診斷。此外,對毒蕈鹼樣乙醯膽鹼受體配體、5-羥色胺受體配體、多巴胺受體配體等的99mTc標記也進行了大量研究,並且取得了可喜的進展,期望能得到用於臨床的99mTc標記的腦受體顯像劑。
3、鎝(99mTc)心肌放射性藥物
99mTc心肌放射性藥物在冠心病的臨床診斷與心臟功能的測定方面具有重要意義。根據其用途,主要分為以下幾類:
(1)99mTc心肌灌注顯像劑
正常心肌細胞對某些放射性核素或放射性藥物如201Tl、99mTc--MIBI等有選擇性攝取能力,其攝取量和冠狀動脈血流量及心肌細胞活性相關,冠狀動脈狹窄或阻塞致心肌缺血、梗死等,病變區攝取量減少或不攝取,顯像表現為放射性稀疏或缺損。這類顯像劑稱心肌灌注顯像劑,可對心肌缺血、心肌梗死等冠心病、原發性心肌病進行診斷,也可用於評價冠心病的療效等。目前臨床上常用的顯像劑有201Tl和99mTc-心肌灌注顯像劑。
99mTc-心肌灌注顯像劑必須與局部心肌血流直接相關,心肌攝取高,具有快速的血清除、肺清除和肝清除。目前FDA已經批准或處於臨床試驗階段的99mTc-心肌灌注顯像劑有:99mTc-sestamibi、99mTc-tetrofosmin、99mTc-furifosmin、99mTc-teboroxime和99mTcN(NOEt)2。
①99mTc-MIBI是臨床上最常用的心肌灌注顯像劑。缺點是無再分布性質,鑑別缺血和梗死心肌時,需兩次給藥,分別做運動和靜息顯像。並且它主要經肝膽系統排泄,注射後需服用脂肪餐。最近,報導了以99mTc(CO)3為核心的新的MIBI配合物。該配合物的心肌顯像不受肝影的影響,很有可能成為一種比99mTc-MIBI更為理想的心肌灌注顯像劑。②99mTc-tetrofosmin(P53)的優點是標記過程簡單,已被FDA通過用於臨床。③99mTc-furifosmin目前正處於臨床試驗階段。④99mTc-teboroxime是快速心肌顯像劑,但由於它在心肌中的洗出較快,需用多探頭SPECT才能快速完成數據採集,因此至今沒有得到廣泛套用。⑤99mTcN(NOEt)2是零價配合物,具有再分布的特性,目前正處於臨床試驗階段。
(2)99mTc心肌梗塞顯像劑
新鮮梗塞的心肌組織,如急性心肌梗塞區,可以濃集某些放射性藥物。目前99mTc標記的心肌梗塞顯像劑主要分三類:第一類是親骨性顯像劑,如99mTc-PYP、99mTc-MDP、99mTc-HEDP等。第二類是非親骨性顯像劑,如99mTc-GH、99mTc-DMSA和99mTc-GLA等。第三類是抗肌凝蛋白抗體片段顯像劑,如99mTc-MA-Fab。它也是非親骨性顯像劑,也可用111In等核素標記,用於心肌梗塞的顯像。
(3)心肌乏氧組織顯像劑
 放射性藥物
放射性藥物(4)99mTc心血池顯像劑
心血池顯像劑可以用來診斷心臟的功能,如檢查先天性心臟病、房或室間隔缺損及其他心腦血管系統障礙等疾病。它不僅有效,而且還是其他方法無法替代的。目前,臨床上使用最普遍的心血池顯像劑有99mTc標記的紅細胞(99mTc-RBC)、99mTc標記的人血清白蛋白(99mTc-hsa,包括99mTc直接標記的HSA和99mTc通過雙功能聯接劑標記的HSA)等。
關於99mTc標記的心肌代謝顯像劑和心肌受體顯像劑,國內外雖進行了多年的探索,但至今未取得突破。而與心血管疾病有重要影響的99mTc標記的血栓顯像劑以及對冠心病的早期診斷和治療有密切關係的動脈粥樣硬化斑塊的99mTc顯像劑的研究已成為近年來大家關注的熱點。
(5)99mTc血栓顯像劑
靜脈和動脈血管內血栓的形成會導致心肌梗塞、心絞痛、腦中風及卒死等嚴重後果,因此對血栓顯像劑的研製、準確無損傷地測定動脈和深部靜脈的血栓就成為放射性顯像藥物近年來十分重要的進展。血栓是血管內纖維蛋白、血小板和紅細胞凝聚而成,血栓的形成過程受纖維蛋白原的調節,纖維蛋白原通過Arg-Gly-Asp(RGD)序列的基質(motif)與
 99Tcm-TRADOT-1
99Tcm-TRADOT-1GPIIb/IIIa受體結合,而RGD單元與GPIIb/IIIa受體的拮抗劑DMP757具有高親和力,因此用99mTc標記DMP757就可以進行血栓的顯像。另一種GPIIb/IIIa受體的拮抗劑DMP444也顯示對深部靜脈血栓(DVT)有很好的顯像,在注射15分鐘後即可看到血栓。此外,P280和P748也是GPIIb/IIIa受體血栓顯像劑,其中P280已經被FDA批准上市,它可在注射後5分鐘進行靜脈血栓顯像,而P748可用於肺栓塞顯像的研究。
1.2.1.399mTc腫瘤放射性藥物
(1)99mTc單克隆抗體腫瘤顯像劑
用99mTc標記單克隆抗體作為腫瘤的顯像劑,是近年來鎝放射性藥物的研究熱點之一。將99mTc核素通過直接或間接的方法標記到單抗上,利用抗體與抗原的免疫結合,特異定位到一定抗原的腫瘤組織上進行顯像,可為人類癌症的診斷提供方便、經濟和有力的工具。
目前,99mTc標記的抗體分為兩類,一是99mTc直接與抗體分子或抗體片段形成價鍵結合,二是通過雙功能聯接劑與抗體間接結合。FDA批准用於臨床的有99mTc-arcitumomab和99mTc-nofetumomabmerpentan等。99mTc-抗CEA單抗對復發腫瘤的診斷準確率為90%,利用N2S2雙功能聯接劑的99mTc標記抗體在診斷黑色素瘤轉移灶中具有高的靈敏度和解析度,對已知腫瘤轉移灶的診斷率為81%。
(2)99mTc-多肽放射性藥物
儘管單克隆抗體顯像藥物在腫瘤診斷和治療方面取得了很大的進展,但由於抗體的異源性、抗體與抗原結合較弱以及攝取量過小、靶/非靶的比值較低等原因,妨礙了它的有
 FDG
FDG效套用。99mTc標記的多肽受體顯像劑恰能彌補這些缺點,特別是小分子多肽,幾乎不存在抗體的異源性問題,同時可以人工合成、易於質量控制且具有與受體結合的高度特異性。99mTc標記的多肽不但可以用於血栓顯像和感染/炎症顯像,而且可以用於腫瘤顯像。
奧曲肽是生長激素抑制素(簡稱SMS)族的一員,是由八個胺基酸組成的多肽。很多腫瘤細胞膜表面具有SMS受體,如胃腸道類疾病、小細胞肺癌、卵巢、宮頸、乳腺等腫瘤,從而可對它們進行顯像。如99mTc-P829對原發性非小細胞肺癌的診斷率為100%,轉移灶的診斷率為82%。然而SMS顯像也有不足之處,因為有些腫瘤細胞的表面並沒有SMS受體的表達,如胰腺癌等。但在許多腫瘤細胞表面都有對血管活性腸肽(VIP)有很高親和力的受體表達,而且VIP的表達常高於SMS表達,如腸道腺癌、胰腺癌、與內分泌有關的腫瘤、黑素瘤及淋巴瘤等。因此可以用99mTc-VIP對上述腫瘤進行顯像和診斷。
(3)腫瘤細胞多藥抗藥性顯像劑
腫瘤細胞表面的P糖蛋白(Pgp)可以將毒物(藥物)排出細胞外面,其過度表達是腫瘤細胞多藥抗藥性的最好表征。多藥抗藥性大的腫瘤細胞,99mTc-MIBI排出細胞外的就多,反之就少。因此可以用99mTc-MIBI的顯像來測定多藥抗藥性的大小。其他陽離子灌注顯像劑如99mTc-tetrofosmin、99mTc-furifosmin也可用來測定多藥抗藥性。
綜上所述,99mTc標記的受體藥物已取得了不同程度的成功,其中靶目標是細胞表面受體,但對於細胞內受體配體的研究,如癌細胞內通常過量表達孕甾酮、雌激素和雄激素等研究,尚處於初級階段,有待積極開拓。
1.2.2123I放射性藥物
123I是加速器生產核素,具有優良的核性質,其性質較用其他放射性金屬核素的標記物更接近前體藥物的生化特性,因此碘(123I)的顯像藥物在臨床診斷中的套用仍有重要地位。
眾所周知,利用123I-可以進行甲狀腺功能的測定和甲狀腺顯像。123I-IMP已被FDA批准用於腦的血流量測定。123I-脂肪酸可用於心肌缺血部位的顯像和心肌代謝的研究。123I-MIBG可用於腎上腺髓質顯像和心肌受體顯像。123I標記的19-碘膽固醇、6-碘甲基-19-去甲基膽固醇和6-碘膽固醇可用於腎上腺顯像,123I-鄰碘馬尿酸可用於腎功能測定和腎臟顯像,123I標記的各類單克隆抗體也可用於腫瘤定位顯像。
 顯像圖片
顯像圖片1.2.367Ga、111In、201Tl等放射性藥物
加速器生產的67Ga、111In、201Tl也是SPECT顯像核素,這些核素標記的放射性藥物已廣泛地用於心肌、腫瘤等疾病的診斷,由於時間關係,本部分內容不再詳細介紹。
(二)體內治療放射性藥物
診斷用放射性藥物只是作為一種疾病診斷的手段,診斷的最終目的是為了治療。可利用的治療核素有211At、212Bi等發射α粒子的核素和32P、47Sc、64Cu、89Sr、90Y、105Rh、111Ag、117mSn、131I、149Pm、153Sm、166Ho、177Lu、186Re、188Re等發射β粒子的核素。近年來,由於發射低能俄歇電子的核素如67Ga、123I、125I、201Tl等具有高的線性能量轉換(LET)和在生物組織中射程短等優點,因此這些核素在腫瘤治療研究中受到越來越多的重視。體內治療用放射性藥物可分為兩類:一類是利用放射性藥物在臟器中的選擇性濃集與放射性核素的輻射效應來抑制和破壞病變組織(如腫瘤)以達到治療目的;另一類為內介入法放射性治療藥物,如將放射性藥物埋入或局部注射到腫瘤組織內,以達到殺傷癌細胞的目的。目前,利用第一類藥物(如放射性標記的化學小分子、單抗或單抗碎片、小分子肽類等)進行研究治療的疾病有肝癌、結腸癌、甲狀腺癌、骨腫瘤和膀胱癌等。FDA通過的該類常規治療用放射性藥物有用於甲亢和甲狀腺癌治療的131I-NaI、用於惡性血液病治療的32P-磷酸鹽、用於骨癌和骨轉移癌引起的骨疼痛治療的32P-正磷酸鈉、89SrCl2、153Sm-EDTMP等。用於骨疼痛治療的186Re-HEDP、117mSn-DTPA正處於臨床試驗階段。用於治療嗜鉻細胞癌、神經細胞瘤的藥物有131I-MIBG等。此外,64/67Cu和90Y標記的治療用放射性藥物處於臨床試驗階段,186/188Re標記的生物分子研究也十分活躍。利用第二類放射性藥物進行治療的如90Y-GTMS(玻璃微球)、32P-GTMS、153Sm-GTMS、131I-碘油、125I碘油等用於肝癌介入治療,32P、166Ho和90Y(OH)3膠體等用於腦膠質瘤治療等。利用32P、125I、198Au和192Ir等核素研製成“種子”或“膨脹架”植入血管狹窄處,對動脈管壁上的疤痕組織平滑肌細胞增生或粥樣硬化斑塊進行射線“老化”處理,是治療冠狀動脈狹窄或再狹窄很有套用潛力的方法,此外125I和103Pd“種子”對治療前列腺癌也很有成效。
適宜的射線能量和在組織中的射程是選擇性集中照射病變組織而避免正常組織受損並獲得預期治療效果的基本保證,各種常用治療放射性藥物的理化性能見表1-3。
發射純β-射線的放射性治療藥物32P、89Sr、90Y等
發射β-射線時伴有γ射線的放射性治療藥物131I、153Sm、188Re、117mSn、117Lu等
131I目前仍是治療甲狀腺疾病最常用的放射性藥物;89SrCl2、153Sm-EDTMP、117Snm-DTPA和177L
u-EDTMP等放射性藥物在骨轉移癌的緩解疼痛治療中也取得了較為滿意的效果。近年來可由188w-188Re發生器獲得188Re作為治療用放射性藥物受到重視,它發射的β-射線能量為2.12MeV;γ射線能量為155keV,T1/2為16.9h。通過發射β-射線產生電離輻射生物效應破壞病變組織,並可利用其發射的γ射線進行顯像,估算內照射吸收劑量和評價治療前後病變範圍變化。目前188Re-HEDP已用於治療惡性腫瘤骨轉移骨痛、188ReO4-治療或預防血管成型術後再狹窄和188Re-碘油介入治療肝癌等。
發展現狀
單光子放射性藥物發展現狀:
自1985年以後一批99mTc標記的放射性藥物的研製和合成,如99mTc-sestamibi、99mTc-ECD、99mTc-DTPA等已成為心肌灌注顯像、腦血流灌注顯像和腎動態顯像的常用顯像劑,此外,99mTc-N(NOEt)2、99mTc-HL91、99mTc-TRADOT-1等一批新型放射性藥物也即將套用於臨床。
正電子放射性藥物發展現狀:
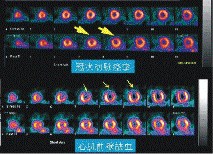 99mTc-MIBI心肌血流灌注顯像
99mTc-MIBI心肌血流灌注顯像20世紀80年代,中國原子能科學研究院同位素研究所用反應堆生產了18F,並人工合成了18F-FDG。由於生產的量不足,加之國內沒有相應臨床顯像裝置,該藥物沒有套用於臨床。80年代末,該所從比利時IBA公司引進質子加速器,但沒有引進PET掃描機,故一直未能生產正電子藥物,直到中日友好醫院採用國產二環PET後才開始了18F-FDG的臨床套用。90年代初,北京幾家醫院曾先後申請成立PET中心,但未能成功。1995年山東淄博萬傑醫院從GE引進成套設備,開始了中國真正意義上的正電子藥物生產和套用,但該設備僅生產18F-FDG和13N-NH+4兩種正電子藥物。中國科學院上海套用物理研究所同期也引進IBA加速器和合成器,為醫院引進的PET提供18F-FDG藥物。90年代末北京、上海、廣州相繼引進小型質子加速器,生產18F-FDG以供臨床使用。2000年在北京召開的第一屆高能正電子會議上,僅有18F-FDG和13N-NH+4兩種藥物的報導;到2002年上海召開第二屆高能正電子會議才有11C-Raclopride和11C-膽鹼等藥物的報導。此後國內研究和臨床套用的正電子藥物不斷增加,目前其種類已經超過了20種。
製備
放射性藥物除以放射性核素的無機化合物形式出現外,大多數是以放射性核素與配體結合的形式存在。因此,放射性藥物的製備一般包括3個步驟:生產放射性核素、合成配體、放射性核素與配體的結合(配體的標記)。
一、放射性核素
製備放射性藥物的放射性核素有2個來源:基本來源與次級來源。基本來源是利用核反應堆或醫用回旋加速器直接生產的放射性核素;次級來源是從放射性核素髮生器裝置間接獲取的放射性核素。
(一)基本來源
1.核反應堆生產利用核反應堆強大的中子流轟擊各種靶核,吸收中子後的靶核發生重新排列,變為不穩定的(放射性的)新核素。這些核反應可分別用符號(n,p)、(n,α)、(n,γ)及(n,f)表示。n為中子,p為質子,α為α粒子或氦核,γ為γ射線,而f表示裂變。對核醫學套用來說,(n,γ)和(n,f)反應是核反應堆生產放射性核素最重要的核反應。表1列出核反應堆生產的部分醫用放射性核素。
核反應堆生產的放射性核素優點是:能同時輻照多種樣品;生產量大;輻照時間短;操作簡單等。缺點是:多為富中子核素,通常伴有β-衰變,不利於製備診斷用放射性藥物;核反應產物與靶核大多數屬同一元素,化學性質相同,難以得到高比活度的產品。
2.加速器生產回旋加速器是通過電流和磁場使帶電粒子得到加速,以足夠的能量克服原子核勢壘,引起不同核反應,生成多种放射性核素。這些核反應可分別用符號(d,p)、(α,d)、(α,p)、(p,n)表示;n為中子,d為氘核,p為質子,α為氦核。表2列出了加速器生產的部分醫用放射性核素。加速器生產的放射性核素特點是:大部分是貧中子核素。通常為發射β+或EC衰變。正電子淹沒放出能量相同方向相反的2個511keV光子,利用PET或雙探頭符合線路探測,提高了核醫學影像的解析度;大部分是短半衰期或超短半衰期核素,可以給患者較高放射性活度的藥物,縮短收集信息的時間,也可在較短的時間內重複進行核醫學檢查,污物較易處理;比活度高。大多數靶核與生成核素不屬核素,在生產時易於化學分離,使之成為無載體或高比活度,便於醫學套用。缺點是:水電資源消耗大,靶材料及制靶系統要求高等。
(二)次級來源
放射性核素髮生器是一種從放射性核素母子體系中周期性分離出子體的裝置。放射性母子體系中,母體核素不斷衰變,子體核素不斷增加,最後達到母子體放射性平衡。由於母子體系不是核素,易於用放射化學方法分離。每隔一段時間,分離一次子體,猶如母牛擠奶,故放射性核素髮生器又稱“母牛”。以母子體系分離方法的不同,分為色譜發生器、萃取發生器和升華發生器。當前均以母子體系的核素名稱命名發生器,最常用的發生器是99鉬-99m鎝[99Mo-99mTc]色譜發生器,簡稱99m鎝[99mTc]發生器。
在99m鎝[99mTc]發生器中,依99鉬[99Mo]的生產方法不同,可分為核反應堆輻照天然鉬、富集98鉬[98Mo]、235鈾[235U](裂變)製得的99m鎝[99mTc]發生器。此外具有中國特色的以核反應堆輻照天然鉬製備的(凝膠)99m鎝[99mTc]發生器,僅在中國有商品供應。其優點是以天然鉬為靶材料,成本低,以鉬酸鋯醯凝膠裝柱,克服了色譜吸附劑吸附容量限制的困擾,從而製成高放射性活度的發生器。其缺點是:洗脫效率低,洗脫曲線峰半寬度較寬,峰位靠後導致洗脫體積大,“奶”液放射性濃度低。
上述放射性核素髮生器除188W-188Ra發生器外,均為診斷用品。隨著對發展治療藥物的重視,188-W188Ra發生器很可能成為臨床核醫學常用的另一种放射性核素髮生器。
二、配體——非放射性的被標記物
非放射性的被標記物通常稱配體,主要根據診斷和治療的不同目的來設計。例如為了實現放射性核素99m鎝[99mTc]通過血腦屏障,灌注並滯留在腦內,設計了依沙美肟(exametazimed,1-HMPAO);為了使放射性核素較長時間滯留在骨組織中,設計了多種含磷(膦)化合物;為了使放射性核素濃集在腫瘤中,可以製備該腫瘤抗原的單克隆抗體,然後用放射性核素標記該單抗,使其在體內特異地濃集在該腫瘤中。從這些例子不難看出,非放射性被標記物(配體)的作用,是攜帶放射性核素並將其濃集在所希望的靶器官或組織,以達到診斷或治療的目的。配體是多種多樣的,它可以是一般的化學藥物,如二巰丁二鈉(DMS,二疏基丁二酸鈉),抗生素如博來黴素(BLM),血液成分如紅細胞(RBC),生物製品如單克隆抗體。但也有一些配體是專門為核醫學診斷或治療設計的,如大多數心肌灌注顯像放射性藥物的配體等。對非放射性被標記物(配體)的基本要求是:
(1)使用劑量為毫克級,無毒副反應。
(2)能提供一個官能團,便於放射性核素標記。
(3)放射性核素標記後的產品,具有體內外穩定性。
(4)易於製成“藥盒”。
三、放射性核素與配體的標記方法
少數放射性藥物的生物學行為僅表現在放射性核素方面,不是元素133氙[133Xe],就是完全離子化的分子(Na99mTc、Na131I、201TlCl)。這些放射性藥物沒有標記的問題。只有當生物學行為表現在非放射性部分或放射性核素和非放射性被標記物兩部分時,就涉及標記方法和技術問題了。
一般來說,放射性藥物的標記方法包括合成法(生物合成、化學合成)、交換法、絡合法(直接、間接絡合)等。
1.生物合成法是利用動物、植物或微生物的代謝過程或生物酶的活性,將放射性核素引入到需要的分子上。胰腺顯像用的75硒[75Se]蛋氨酸,就曾經以生物合成的方法製備。對於生物大分子和結構複雜的難以通過化學反應途徑進行標記的物質,以及為獲得那些在生化過程中有重要意義的標記物,生物合成法是一種很有用的方法。但在放射性藥物製備中,現在已很少用了。
2.化學合成法是製備放射性藥物的最經典的方法,其原理與普通化學合成法相似,只是在合成中使用了放射性核素作為原料。化學法又分為逐步合成法(以最簡單的放射性化合物按預定合成路線一步步合成複雜的有機標記化合物)、加成法(通過加成反應將不飽和有機分子製備成標記化合物)、取代法(有機分子中的原子或原子基團被放射性核素或其基團所置換)等。
3.交換法是標記分子中一個或幾個原子,被具有不同質量數的同種原子的放射性核素所置換的標記方法。由於標記上的放射性核素與被標記分子上被置換的非放射性原子是核素,因此,除了有核素效應外,它們的理化和生物學性質是相同的。
交換反應是可逆反應,可通過調節反應條件(溫度、pH等)和加入催化劑控制反應的進行。
4.絡合法大部分放射性藥物是利用放射性核素以共價鍵或配位鍵的形式絡合到標記的分子中,被標記分子不含標記的放射性核素的核素,這種標記法稱非核素介入法。雙功能螯合劑法也屬這類標記法,不同的是,先把某種雙功能螯合劑聯接在被標記的分子上,再將放射性核素標記到螯合劑上,形成“放射性核素螯合劑被標記物”的複合物。此種方法大多用來標記多肽、單克隆抗體等。由於螯合劑的存在,被標記物有可能出現理化和生物學性質的改變,在臨床套用前應予注意。
四、放射性藥物標記製備應考慮的要素
標記方法的選擇,標記產率的高低,是放射性藥物標記製備的重要因素。
1.標記產物的穩定性放射性核素與被標記物之間鍵合的形式與穩定性密切相關,通常共價鍵結合的標記化合物相對穩定。
2.失活或變性標記過程中,由於標記條件的影響,使被標記物結構改變或喪失生物活性。
3.核素效應由於核素相互間質量不同而引起的理化和生物學性質的改變稱核素效應。原子量大的核素間核素效應微乎其微,但氚標記是個例外。
4.輻射自分解由於標記化合物自身的放射性核素髮出的粒子或射線作用,導致自身分解的現象。放射性藥物的比活度越高,越易發生輻射自分解。
