發展階段
因素
 成骨細胞
成骨細胞成骨細胞在骨形成過程中要經歷成骨細胞增殖,細胞外基質成熟、細胞外基質礦化和成骨細胞凋亡四個階段。很多因素可調節這幾個階段,從而最終調控骨形成。成骨細胞增殖期成
骨細胞數量增加,以形成多層細胞,併合成、分泌Ⅰ型膠原以便最終可以礦化形成骨結節。對成骨細胞增殖的調控具體說來即是對細胞周期的調控,後者包括細胞在有絲分裂原作用下複製DNA和細胞分裂的調節機制,典型的成骨細胞細胞周期時間為20~24小時。抑制與細胞周期調節相關的基因會導致增殖的停止。
有關的基因
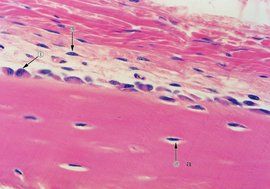 骨鈣素
骨鈣素與增殖激活有關的基因有c-myc、c-fos、c-jun;與細胞周期有關的基因有組蛋白、細胞周期素基因。在顱蓋骨分骨細胞培養中觀察到細胞從顱蓋骨中分離後很快即出現最高水平的c-fosmRNA表達,比c-myc和H4組蛋白基因表達早許多。c-mycmRNA常在1天后表達達到高峰,H4組蛋白基因表達伴隨細胞內DNA合成,與增殖密切相關。c-fos、c-jun基因表達在增殖晚期明顯下調,同時伴隨成骨細胞增殖減慢,細胞由增殖期進入分化期。c-fos對成骨細胞增殖的作用在體內實驗中也得到證實,如在人的長骨與胚胎骨生長旺盛的區域c-fos原癌基因高表達。另有報導,c-fos高表達的小鼠中骨形成也會增加,這些均證明c-fos與成骨細胞增殖有關。而且c-fos與c-jun編碼的蛋白質c-fos,C-jun能形成異二聚體,作為轉錄因子結合到基因啟動子區的AP-1位點,已觀察到在增殖的成骨細胞中有很高的AP-1結合活性,而在增殖下調後,這種高活性也明顯改變,這說明原癌基因可能通過c-fos/c-jun複合物來調節細胞增殖。在成骨細胞增殖期,同時還能表達的基因有表皮生長因子(FGF)、胰島素樣生長因子(IGF)、轉化生長因子β(TGFβ)、Ⅰ型膠原、纖維連線(fibronectin)等基因。在細胞增殖晚期,與細胞周期與細胞增殖相關的基因表達下降,而編碼細胞外基質成熟的蛋白的基因開始表達,在分化早期主要是鹼性磷酸酶表達,因此鹼性磷酸酶被認為是細胞外基質成熟的早期標誌,AKPmRNA表達此時可增加10倍以上。有學者用羥基脲抑制成骨細胞增殖,加入羥基脲1小時後觀察到DNA合成和H4組蛋白mRNA下降90%,與此同時,AKPmRNA增加4倍,證明增殖下調可提前誘導AKPmRNA表達。成骨細胞分泌AKP和鈣鹽結晶體至細胞外基質中,AKP使局部磷酸含量增高,促使基質礦化。在細胞外基質成熟期,膠原繼續合成並相互交聯、成熟。在成骨細胞分化晚期,當培養細胞進入礦化期,細胞內的AKP活性下降,而與細胞外基質中羥磷灰石沉積相關的基因表達達到高峰,如骨橋蛋白(osteopontin)、骨鈣素、骨唾液酸白
(bonesialoprotein)基因。骨鈣素等非膠原蛋白分泌至細胞外基質中,與鈣、磷結合,然後,沿膠原分子的長軸,鈣和磷結合到膠原分子的側鏈的膠原胺基酸殘基上,形成羥磷灰石結晶。在用羥基脲抑制增殖的實驗中同時可觀察到,與AKP不同,骨鈣素,骨橋蛋白的mRNA表達不因增殖抑制而增加,證明它們與增殖無關而可能與礦化基質中成骨細胞分化有關。Owen在體外實驗中進一步觀察β-磷酸甘油(β-GP)對骨鈣素產生的影響,β-GP是羥磷灰石形成的原料,能被AKP迅速水解,釋放出無機磷。如果培養中沒有β-GP時,即使細胞通過細胞外基質成熟期進入礦化階段,骨鈣素基因也不能表達,說明在沒有礦物質沉積時不能形成骨細胞。
階段的基因
表達礦化階段的基因。體外培養的成骨細胞在骨礦化期骨鈣素高度增加,此後,骨鈣素逐漸降低,與此同時,可觀察到膠原酶增加,成骨細胞開始凋亡,並出現代償性細胞增殖和膠原合成。
