簡介
固定劑最先套用在光學顯微技術中,但光學顯微鏡中使用的沉澱凝集蛋白性的固定劑對電鏡並不特別適用。於是人們引入四氧化鋨和中性甲醛進行固定。早期的電鏡生物樣品化學固定法都採用四氧化鋨單一固定,但四氧化鋨不能很好地保存糖原和其它碳水化合物,而且四氧化鋨在組織中的滲透速度比較慢(約2mm/h)。
而早期使用的中性甲醛也令人很不滿意,因為早期使用的甲醛很不純,含有甲酸和甲醇的殘留(一般有10-15%),甲醇的存在對樣品的保存很不利,於是後來人們改進了甲醛的製備方法,使用多聚甲醛新鮮配製甲醛,提高了它的純度。1963年Sabatini、Bensch和Barrnett推薦使用醛類(特別是戊二醛)作為初級固定劑。使用戊二醛或戊二醛-多聚甲醛初步固定後再使用四氧化鋨後固定的雙重化學固定對大多數動物和植物組織都十分有效,因而成為目前大多數實驗室常規的固定方法。
使用注意:
電鏡中使用的固定劑都有毒性,操作時都要很小心,儘可能在通風櫥中完成操作。如果實驗室中發生固定劑泄漏,必須立即用大量奶粉覆蓋泄漏出來的溶液,待反應充分後收集處理。
種類:
四氧化鋨(Osmium tetroxide)
四氧化鋨是一種很強的氧化劑,呈淺黃色結晶,分子量254,飽和水溶液的濃度為7.24%,它的水溶液為中性,有極大毒性。市售有密封的四氧化鋨晶體和四氧化鋨水溶液兩種。四氧化鋨晶體溶於水的速度很慢,必要時可以使用超音波設備來加速溶解。市面上也有已經配製好的2%四氧化鋨水溶液出售,使用相當方便。但要特別注意的是無論是四氧化鋨晶體還是水溶液都會揮發出四氧化鋨氣體,因此應將四氧化鋨置於密閉容器(玻璃容器)中保存。四氧化鋨氣體對呼吸系統有刺激,對眼睛有嚴重的破壞作用,因此在使用時應特別小心,儘可能在通風櫥中進行,並且嚴格控制用量。廢棄的四氧化鋨溶液應加入酒精水溶液或硫酸亞鐵溶液,使四氧化鋨轉化為黑色沉澱,以降低毒性方便收集處理。
四氧化鋨作為固定劑有如下優點:
1.四氧化鋨可以與脂類、糖類和蛋白質反應。其對脂類的固定作用可以補充醛類固定劑對脂類固定不足的缺點。其反應方程式如下:
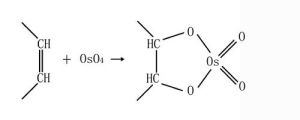 固定劑
固定劑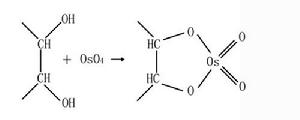 固定劑
固定劑2.能增加膜的反差,起到"電子染色"作用。用四氧化鋨固定的材料,往往細胞膜結構比較清晰。這是由於被還原的鋨沉積在細胞膜結構上,而鋨是一種原子序數較高的元素,能加強它們的電子散射(質量密度大),所以四氧化鋨作為固定劑的同時,又可作為電子染料,使被固定的樣品圖像有較好的反差。
3.四氧化鋨會破壞大部分細胞膜的半透膜特性,配製四氧化鋨固定液不用考慮滲透壓。
四氧化鋨雖然具有以上優點,但它也存在不少缺點:
四氧化鋨滲透力弱,所以組織塊要小。否則,將從組織塊表面到中間形成一個固定梯度,致使內部自溶過程繼續進行引起組織塊內部固定不好。
不能保存糖原也不能有效固定核酸,而且對微管固定效果也不理想。
固定的時間不宜太長。時間過長,會使組織變脆,給切片帶來困難。此外四氧化鋨與蛋白質、不飽和脂肪酸交聯形成的複合體都是易溶於水的物質,特別是在長時間的固定後,更易溶解。因此,使用四氧化鋨固定樣品,時間控制在12小時較為適宜。
四氧化鋨能與乙醇或醛類起氧化-還原反應,生成沉澱。所以,醛類處理過的樣品轉入四氧化鋨固定之前或四氧化鋨固定之後轉入乙醇溶液脫水之前都必須用相應的緩衝液充分漂洗乾淨。
四氧化鋨是酶的鈍化劑,不能用於細胞化學的研究。
醛類固定劑
甲醛(formaldehyde)
甲醛分子中只有一個碳原子,含有一個醛基,分子式為$CH_2O$,分子量為30。市面上雖然有多種形式的甲醛溶液出售,但它們含有少量的甲酸和甲醇,對被固定的樣品產生不良影響,適合電鏡固定使用的只有通過由多聚甲醛(paraformaldehyde)新鮮製備的甲醛溶液。甲醛溶液的毒性很大,即使是稀釋液也要格外小心操作。甲醛溶液對皮膚有硬化作用,長時間接觸可能導致皮膚破裂、皮炎或是過敏症狀;甲醛極易揮發,它對呼吸道也有影響,長時間暴露在甲醛氣體中會使嗅覺敏感度降低;此外甲醛對眼睛也有影響,而且還被認為是致癌物質。因此在操作甲醛粉末或溶液時都必須很小心,帶上手套並在通風櫥中進行。少量廢棄的醛類試劑(甲醛、戊二醛和丙稀醛等)可以直接在大量流水沖稀的情況下倒進水池內(但要注意有關部門的有關規定),當然少量的醛類試劑與過量的1M甘氨酸混合後,再在大量流水沖稀的情況下倒進水池,會更安全。通常100ml的甲醛(1%)需要50ml的1M甘氨酸,100ml1%戊二醛則需要35ml,而丙稀醛需要40ml。大量的醛類試劑必須集中回收處理。
甲醛作為固定劑有如下特點:
由於甲醛的分子量小,它的穿透能力比戊二醛強,反應溫和,可用於細胞組織化學研究的前固定。而且它不象戊二醛有兩個醛基,引入較少的游離醛基到組織細胞中,因而在一些細胞組織化學研究中更有利。但它的反應是部分可逆的,對細胞基質保存差,脫水後大部分基質丟失,所以不少實驗室不單獨使用甲醛來固定樣品,而將它與戊二醛配製成混合固定液使用。
甲醛對生物樣品的作用與戊二醛相似,主要引起蛋白質交聯。在水溶液中,單個的甲醛分子以HO − CH2 − OH的形式存在。反應如下:
 固定劑
固定劑與戊二醛不同,甲醛既與DNA又與核蛋白反應,但這些反應都是部分可逆的。另外,甲醛固定脂類的能力不強,可以與脂類相連的蛋白質作用。
戊二醛(glutaraldehyde)
戊二醛是一種五碳醛,含有兩個醛基。分子式為$C_5H_8O_2$,分子量為100。電鏡固定通常用市售的25%的戊二醛水溶液稀釋成需要的濃度。其pH為4.0$\sim$5.0。氧氣、高溫、中性或鹼性pH均能使戊二醛發生聚合失去醛基,並降低交聯效力,所以平時這種原液應保存在低溫處。此外戊二醛存放時間過長時,pH值會降低,顏色變黃,固定效力也大大降低,若戊二醛pH值降至3.5以下或含有其它雜質時,必須純化後才能使用。戊二醛對皮膚有硬化作用,但它的揮發性較甲醛弱,最好能在通風櫥中操作。
戊二醛作為固定劑有如下特點:
它的反應速度快,是優良的前固定劑。但它的滲透速度較慢,必要時配合甲醛使用效果更佳。
它是蛋白質的強固定劑。它能快速而不可逆地與氨基反應,和甲醛相似,戊二醛的一個醛基與氨基反應,脫水後生成不穩定的Schiff鍵化合物。其反應的可能途徑如下:
 固定劑
固定劑由於戊二醛有兩個醛基,它可以通過與相鄰的另一氨基反應,而產生交聯作用。戊二醛的兩個醛基也可能與同一氨基作用,形成環狀結構,如下
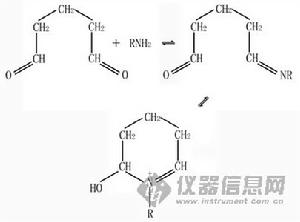 固定劑
固定劑這種環狀結構可以進一步與另一戊二醛反應,生成丁間醇醛冷凝物(Aldol condensate)。這種化合物與氧分子共同作用,生成穩定的嘧啶類衍生物(Pyridine derivatives),並在此過程中發生交聯。
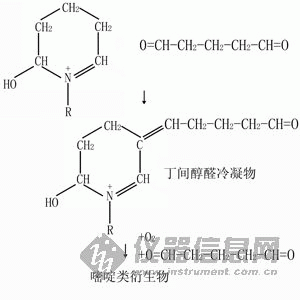 固定劑
固定劑與甲醛不同,戊二醛的這一步反應是不可逆的,而且需要氧氣的參與。由於大塊的樣品內部氧氣供應不足,戊二醛在大塊樣品的內部無法形成穩定的生成物,會導致樣品內部的固定效果不佳。因而在使用戊二醛固定時,小塊的樣品固定效果較為理想。戊二醛通過交聯作用固定蛋白質的過程會伴隨氫離子的釋放,使樣品pH值降低。為了維持pH值穩定在最佳水平,在戊二醛的固定劑中要加入足量的緩衝液。
戊二醛能通過固定核蛋白來固定組織和細胞中的DNA和RNA,能保存糖原,也可以固定和蛋白質有關聯的或含有氨基和亞氨基的脂類。但是只使用戊二醛固定的樣品無法阻止後面的脫水、滲透和包埋過程對樣品脂類的抽提,因而對細胞膜的固定效果不理想。
戊二醛在固定過程中並不完全破壞細胞膜的半透膜特性,因而需要選擇合適的固定液滲透壓,以免造成固定假象。但合適的固定液滲透壓隨被固定細胞和緩衝液的種類改變,很難找到一個通用的滲透壓。在實際操作中,$1.0\%-2.5\%$戊二醛(使用0.1M磷酸鹽緩衝液或0.1M二甲胂酸鹽緩衝液)在一般情況下,已經能提供理想的固定效果。除非觀察到明顯的滲透壓造成的假象,一般不對固定液專門進行滲透壓調節。
用戊二醛前固定的樣品不易變脆,可以進行長時間固定(但最好不要超過一個星期),因而適用於遠離實驗室或野外現場取材。但戊二醛在稀釋溶液中會自行發生一系列反應,因而固定液應儘可能新鮮配製中。
其它固定劑
醋酸鈾(uranyl acetate)}既是一種固定劑又是一種染色劑。它可以與磷酸基團反應,從而固定DNA和RNA,以及含有磷酸基團的磷脂,從而對膜結構的保存有幫助。另外,它可以與蛋白中的酸性基團(如天冬氨酸殘基、谷氨酸殘基)和鹼性基團(如賴氨酸殘基)反應,從而起固定蛋白的作用。但醋酸鈾不能很好得保存糖原。通常在使用了醛類固定劑和四氧化鋨固定劑後,再使用$0.5-1.0\%$的醋酸鈾水溶液,進行第三重固定。操作醋酸鈾時要特別注意,儘管市售的醋酸鈾放射性不強,但它仍是一種潛在的致癌物。醋酸鈾應密封於棕色瓶陰涼處保存。
丙烯醛(acrolein)是一種三碳醛,含有一個醛基和一個雙鍵。它比甲醛和戊二醛活潑,滲透組織的速度也比甲醛和戊二醛快。它可以很好地保存蛋白和磷脂,最好作為甲醛或戊二醛固定液的添加劑使用。通常使用市售密封的100%丙烯醛液體,固定時使用的濃度小於1%。它溶於水的速度慢,毒性很大,著火點低,儲存和使用它都比上述另外兩種醛類危險,非必要時不推薦使用。丙烯醛非常活潑且揮發性很強,即使是操作稀釋後的溶液也要格外小心,所有與丙烯醛相關的操作絕不能離開通風櫥進行,並且最好有經驗豐富的操作者在場指導。丙烯醛適合於固定大塊的樣品,植物組織或有厚細胞壁的微生物樣品,以及表面覆蓋有幾丁質或蠟質的樣品。但丙烯醛不適用於整個動物的灌注固定。
丹寧酸(tannic acid)是一種從植物中提取的物質,泛指五倍子酸(gallic acid)糖苷或多聚糖苷。大分子很難滲透到組織中,因此電鏡中使用低分子量的丹寧酸。丹寧酸既是一種強的固定劑,能固定許多蛋白以及糖類衍生物,又是一種媒染劑,能增強對重金屬(如鈾、鉛)的吸收,從而增強樣品反差,特別是細胞外膜、彈性纖維、細胞連線、肌肉纖維等。由於丹寧酸滲透速度慢,通常只用作滲透速度快的固定劑的添加劑使用。丹寧酸沒有固定的用法,0.5-2.0%丹寧酸和0.5mg/ml皂角苷(saponin,增加丹寧酸的滲透速度)與2.5-4.0\%戊二醛一起使用可以得到良好的效果。但固定時間要延長到3-4小時以上,並且推薦使用醋酸鈾作第三重固定。丹寧酸適用於灌注固定。
重鉻酸鉀(potassium dichromate)在固定中有兩種作用,一是緩衝作用,二是固定作用,幫助保存脂類和糖類。在處理神經組織樣品時,因為重鉻酸鉀能很好地保存髓磷脂,可與四氧化鋨配合使用,作為第二重固定劑。但需要注意的是,重鉻酸鉀是一種致癌物質,應小心操作。
高錳酸鉀(potassium permanganate)可以與脂類反應,增強膜結構的反差。可以保存DNA和糖原,但有一定的抽提作用,幾乎無法固定細胞內的顆粒性或纖維狀結構,可能會引入一些假象。穿透性強,適用於有厚細胞壁或蠟質層包被的植物及昆蟲樣品。使用時可以不加緩衝液,固定時間不宜太長,,0.5-1.0%高錳酸鉀溶液固定30分鐘到2小時。
常用固定劑的配方
(一) 凝固型固定劑
 固定劑
固定劑1、酒精(ethyl,alcohol)
常用95%酒精及純酒精。酒精穿透力強,固定時間常在1小時以內。高濃度酒精有使材料收縮的作用。70%的酒精可作保存液。配製低度酒精必須要用普通酒精即95%的酒精,絕不可用純酒精。酒精為還原劑,不能與鉻酸、鋨酸、重鉻酸鉀等氧化劑配合。酒精可使核酸,蛋白質及肝醣等發生沉澱,但能溶解脂肪及擬脂。
2、鉻酸(chromic acid)
鉻酸是一種很好的保存劑,可以使蛋白質沉澱,組織硬化,但是容易使組織收縮,同時滲透 亦比較緩慢。一般與其它藥劑混合使用,可以成為優良的固定劑。平常與醋酸合併套用,效果良好。特點:易潮解,為強氧化劑。缺點:滲透力弱,易使組織發生收縮。
3、苦味酸(picric acid)
苦味酸對於組織滲透緩慢,且能使組織強烈收縮。但可使蛋白質。核酸等沉澱,並防止過度硬化,對以後增進染色能力很大。一般很少單獨使用,常與其他藥劑混合使用。固定後需要用50%或70%酒精洗滌。特點:滲透力弱,易使組織發生收縮,易爆炸。注意事項:一般用50%或70%酒精洗滌。
4、醋酸(acetic acid)
醋酸為無色透明的液體,刺激性極強,冷則凝結成冰,故又叫冰醋酸。醋酸以與水和酒精配成各種比例的溶液,所用濃度為0.2~5%,也常與其他固定劑配合使用。醋酸穿透性很強,單獨使用,有使原生質膨脹的作用,故常與酒精,甲醛等合用,醋酸為固定染色體的優良固定液,因此固定染色體的固定液中,幾乎都含有醋酸。特點:滲透力強,可使組織產生膨脹作用。
(二) 非凝固型固定劑
1、 福馬林(formalin)
濃度在2~10%的福馬林,為很好的硬化劑,但是滲透力薄弱,而且對材料會引起強烈收縮。所以最好與其他藥劑混合使用,效果會大大增加。注意的是,它亦是一種還原劑,故不宜與氧化劑鉻酸、鋨酸相混。特點:很好的硬化劑,強還原劑;滲透力弱。中性磷酸緩衝福馬林固定劑是喜愛方便的即用型固定劑的組織學技術員的上佳選擇。穩定的中性pH值範圍保證了出色的固定性能。
2、重鉻酸鉀(potassium dichromate)
用作固定劑的濃度1~3%。其水溶液略具酸性,亦為一種強氧化劑。因此不能與酒精、甲醛液等事先儲藏。同時為一種強烈的硬化劑,滲透力薄弱,所以很少單獨使用。特點:強氧化劑,強硬化劑;滲透力弱。常與其它固定劑配合使用。
3、鋨酸(osmic acid)
此物品十分昂貴,其溶液呈中性反應。是一種強烈的氧化劑,不能與酒精、甲醛液混用。鋨酸是目前植物製片中一種最好的固定劑,對細胞里細微的構造能夠良好的固定,並為脂肪性物質唯一固定劑。因此在線粒體及其他細胞器的研究中常常使用。經鋨酸固定後,又能防止用酒精脫水時所產生的沉澱作用。但此種固定劑滲透十分薄弱,同時不易固定均勻,往往外邊過度固定,而裡邊尚未固定完全。所以用作固定的材料應該愈小愈好。
特點:中性;滲透力極弱。電鏡固定常用的固定劑;也是唯一能固定脂類分子的最好的化學固定劑。
4、戊二醛(glutaraldehyde)
特點:能與蛋白質分子的氨基和肽鍵連線形成交連;是最常用的非凝固型固定劑。可以部分保持酶和蛋白質的活性。固定能力比甲醛強。常用於電鏡製片的固定;用緩衝液配製。
(三) 混合型固定液
混合原則:a、優缺點互補;b、膨脹與收縮相互平衡;c、強氧化劑與還原劑應分別配置。
1、酒精-福馬林液
70% 酒精 100 ml
福馬林 2 -10 ml
固定植物一般組織,尤其用在柱頭中的萌發花粉管的固定。固定後的材料,立即用作觀察。通常固定24小時,可長久保存。
特點:不易收縮,常用於固定花粉管。
2、甲醛-醋酸-酒精液(FAA)
50% 或70% 酒精 9 0 ml
冰醋酸 5 ml
福馬林 5 ml
這個固定液在植物研究上,套用最多,為植物組織最常用的固定液。固定時間,不受限制,短為24小時,長可延至數月或數年。野外工作,非常便利。並且固定的材料,不妨礙染色。可用以固定植物的一般組織,但用作細胞學上的固定,不如其他一些專用的固定劑。經此液固定後的材料,可不必洗滌,直接用70%酒精脫水。
特點:過去稱“標準固定液”或“萬能固定液”;是組織形態中常用的固定液;同時可兼做保存液。
3、酒精-冰醋酸液
其中常用為卡諾液(Carnoy)
純酒精 15 ml
冰醋酸 5 ml
可用作植物組織及細胞的固定,通常固定2-24小時,視材料的大小而定。固定以後即用95%的酒精脫水;如用作細胞學上的塗片,固定後可直接回到70%酒精,然後進行操作。
特點:具強滲透力,作用迅速;常用於染色體壓片法的固定。
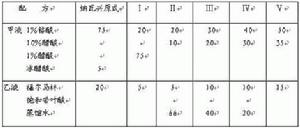
4、鉻酸-醋酸-福馬林液
又名納瓦興液(Nawashin)。1912年首創。常用為冷多夫(Randoph)改良液。
分為甲乙兩部分,用前等量混合。
此液在植物製片上套用甚廣,是細胞學及組織學上一種優良的固定液。此液原來的配方已很少套用,現所用的都是改良液,且種類很多,如材料較柔嫩,含水量較多,可用配方I、Ⅱ;材料較堅硬,含水量較少,可用Ⅳ、V 配方,其中配方Ⅱ對植物胚胎學製片特別適用。為了使用方便,常分別配成甲、乙兩種基液,用時臨時等量配合。固定時間為12-24小時,固定後用70%酒精洗滌數次。
特點:滲透慢,不能長期保存;主要用於顯示分裂相。
5、 精-醋酸-氯仿固定液(Carnoy fixative)
酒精 30毫升
氯仿 5毫升
冰醋酸 1毫升
可用作植物組織及細胞的固定,固定根尖和花葯只需30-60分鐘。不可在此液中放置太久(以不超過一天為宜)。
6、 福馬林-丙酸-酒精液(Johansen fluid)
福馬林 5毫升
丙酸 5毫升
50%酒精 90毫升
此液可用作固定一般植物組織。固定根尖細胞,用作染色體觀察。通常固定24小時,也可長期保存。
7、 鉻酸-醋酸固定液
三氧化鉻 1克
冰醋酸 1毫升
蒸餾水 100毫升
用於容易滲透的材料,如絲狀藻類、菌類、蕨類的原葉體等。固定12-24小時。此液不作保存液。
8、 鉻酸-醋酸-福馬林液(Licent fluid)
1%鉻酸 80毫升
醋酸 5毫升
福馬林 15毫升
固定液中包含氧化劑與還原劑,因此,此液用時需要臨時配製。通常固定12-24小時。
9、 氯化汞-鋨酸固定液(Bensley fixative)
2.5%氯化汞水溶液 4份
2%鋨酸 1份
此液一般可用以固定線粒體,固定12-24小時,水洗。
10、 鉻酸鉀-福馬林固定液(Regaud fixative)
3%重鉻酸鉀 80毫升
福馬林 20毫升
固定高等植物生長點,用以觀察細胞的結構,效果良好。在植物細胞學中多採用為葉綠體的固定液。此液氧化性很強,套用時,最好臨時配製。固定2-12小時。
相關詞條:
相關資料:
[1] 百度貼吧 http://hi.baidu.com/ch_zh07/blog/item/37277046251a0f0f6b63e59d.html
[2]儀器信息網 http://www.instrument.com.cn/search/BBSArchive_650257_1.htm
