介紹
烷烴即飽和烴,烷烴分子中,氫原子的數目達到最大值,它的通式為CnH2n+2。分子中每個碳原子都是sp3雜化。最簡單的烷烴是甲烷。
結構
 人工合成的正十二面體烷C20H20
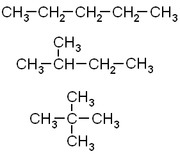
人工合成的正十二面體烷C20H20烷烴中,每個碳原子都是四價的,採用sp3雜化軌道,與周圍的4個碳或氫原子形成牢固的σ鍵。連線了1、2、3、4個碳的碳原子分別叫做伯、仲、叔、季碳;伯、仲、叔碳上的氫原子分別叫做伯、仲、叔氫。“烷”,就是“完”全的意思,碳原子的各鍵完全被氫原子占據。
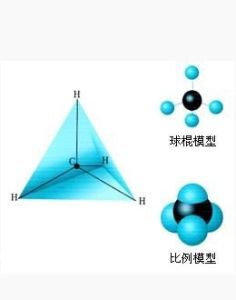
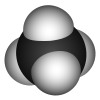
為了使鍵的排斥力最小,連線在同一個碳上的四個原子形成四面體。甲烷是標準的正四面體形態,其鍵角為109°28′(準確值:)。
下面是前10種直鏈烷烴的分子式和結構模型圖。
其他:十一烷、十二烷、十三烷、十四烷
理論上說,由於烷烴的穩定結構,所有的烷烴都能穩定存在。但自然界中存在的烷烴最多不超過50個碳,最豐富的烷烴還是甲烷。
由於烷烴中的碳原子可以按規律隨意排列,所以烷烴的結構可以寫出無數種。直鏈烷烴是最基本的結構,理論上這個鏈可以無限延長。在直鏈上有可能生出支鏈,這無疑增加了烷烴的種類。所以,從4個碳的烷烴開始,同一種烷烴的分子式能代表多種結構,這種現象叫同分異構現象。隨著碳數的增多,異構體的數目會迅速增張。
烷烴還可能發生光學異構現象。當一個碳原子連線的四個原子團各不相同時,這個碳就叫做手性碳,這種物質就具有光學活性。
烷烴失去一個氫原子剩下的部分叫烷基,一般用R-表示。因此烷烴也可以用通式RH來表示。
命名
 烷烴
烷烴烷烴最早是使用習慣命名法來命名的。但是這種命名法對於碳數多,異構體多的烷烴很難使用。於是有人提出衍生命名法,將所有的烷烴看作是甲烷的衍生物,例如異丁烷叫做2-甲基丙烷。
現在的命名法使用IUPAC命名法,烷烴的系統命名規則如下:
找出最長的碳鏈當主鏈,依碳數命名主鏈,前十個以天干(甲、乙、丙...)代表碳數,碳數多於十個時,以中文數字命名,如:十一烷。
從最近的取代基位置編號:1、2、3...(使取代基的位置數字越小越好)。以數字代表取代基的位置。數字與中文數字之間以 - 隔開。
有多個取代基時,以取代基數字最小且最長的碳鏈當主鏈,並依甲基、乙基、丙基的順序列出所有取代基。
有兩個以上的取代基相同時,在取代基前面加入中文數字:一、二、三...,如:二甲基,其位置以“,”(逗號)隔開,一起列於取代基前面。
物理性質
烷烴密度比水小。不溶於水,溶於有機溶劑。熔沸點隨分子量增大和碳鏈增長而升高,同碳數的烷烴,支鏈越多沸點越低。標況下,碳數小於5的(甲烷到丁烷)為氣態,5-17之間的(戊烷到十七烷)為液態,18個碳(十八烷)以上為固態。
化學性質
烷烴性質很穩定,因為C-H鍵和C-C單鍵相對穩定,難以斷裂。除了下面三種反應,烷烴幾乎不能進行其他反應。
氧化反應
R + O2 → CO2 + H2O
所有的烷烴都能燃燒,而且反應放熱極多。烷烴完全燃燒生成CO2和H2O。如果O2的量不足,就會產生有毒氣體一氧化碳(CO),甚至炭黑(C)。
以甲烷為例:
CH4 + 2 O2 → CO2 + 2 H2O
O2供應不足時,反應如下:
CH4 + 3/2 O2 → CO + 2 H2O
CH4 + O2 → C + 2 H2O
分子量大的烷烴經常不能夠完全燃燒,它們在燃燒時會有黑煙產生,就是炭黑。汽車尾氣中的黑煙也是這么一回事。
鹵化反應
R + X2 → RX + HX
由於烷烴的結構太牢固,一般的有機反應不能進行。烷烴的鹵代反應是一種自由基取代反應,反應的起始需要光能來產生自由基。
以下是甲烷被鹵代的步驟。這個高度放熱的反應可以引起爆炸。
鏈引發階段:在紫外線的催化下形成兩個Cl的自由基
Cl2 → Cl* / *Cl
鏈增長階段:一個H原子從甲烷中脫離;CH3Cl開始形成。
CH4 + Cl* → CH3+ + HCl (慢)
CH3+ + Cl2 → CH3Cl + Cl*
鏈終止階段:兩個自由基重新組合
Cl* 和 Cl*, 或
R* 和 Cl*, 或
CH3* 和 CH3*.
裂解反應
裂化反應是大分子烴在高溫、高壓或有催化劑的條件下,分裂成小分子烴的過程。裂化反應屬於消除反應,因此烷烴的裂化總是生成烯烴。如十六烷(C16H34)經裂化可得到辛烷(C8H18)和辛烯(C8H16)。
由於每個鍵的環境不同,斷裂的機率也就不同,下面以丁烷的裂化為例討論這一點:
CH3-CH2-CH2-CH3 → CH4 + CH2=CH-CH3
過程中CH3-CH2鍵斷裂,可能性為48%;
CH3-CH2-CH2-CH3 → CH3-CH3 + CH2=CH2
過程中CH2-CH2鍵斷裂,可能性為38%;
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2
過程中C-H鍵斷裂,可能性為14%。
裂化反應中,不同的條件能引發不同的機理,但反應過程類似。熱分解過程中有碳自由基產生,催化裂化過程中產生碳正離子和氫負離子。這些極不穩定的中間體經過重排、鍵的斷裂、氫的轉移等步驟形成穩定的小分子烴。
在工業中,深度的裂化叫做裂解,裂解的產物都是氣體,稱為裂解氣。
烷烴在工業中
 烷烴
烷烴由於烷烴的製取成本較高(一般要用烯烴催化加氫),所以在工業上不製取烷烴,而是直接從石油中提取。由於烷烴不易發生反應,所以工業上也不把它作為化工基本原料。
烷烴的作用主要是做燃料。天然氣和沼氣(主要成分為甲烷)是近來廣泛使用的清潔能源。石油分餾得到的各種餾分適用於各種發動機:
C1~C4(40℃以下時的餾分)是石油氣,可作為燃料;
C5~C11(40~200℃時的餾分)是汽油,可作為燃料,也可作為化工原料;
C9~C18(150~250℃時的餾分)是煤油,可作為燃料;
C14~C20(200~350℃時的餾分)是柴油,可作為燃料;
C20以上的餾分是重油,再經減壓蒸餾能得到潤滑油、瀝青等物質。
此外,烷烴經過裂解得到烯烴這一反應已成為近年來生產乙烯的一種重要方法。
 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴 烷烴
烷烴