簡介
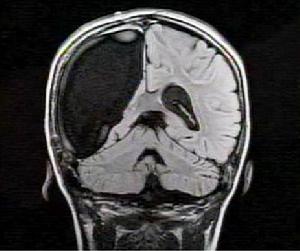 據英國《每日郵報》報導,一個9歲的卡梅倫-莫特在經歷了一個大手術後被去除了半個大腦,但是,小女孩不但活了下來,並且十分堅強地聲稱會繼續追求夢想。可愛的卡梅倫曾因患有Rasmussen綜合徵而不得不接受手術治療——切除半個大腦,讓醫生和家人非常驚訝的是,她不但在手術中康復了過來,而且現在,她還想繼續實現她的夢想——去做個芭蕾舞演員。
據英國《每日郵報》報導,一個9歲的卡梅倫-莫特在經歷了一個大手術後被去除了半個大腦,但是,小女孩不但活了下來,並且十分堅強地聲稱會繼續追求夢想。可愛的卡梅倫曾因患有Rasmussen綜合徵而不得不接受手術治療——切除半個大腦,讓醫生和家人非常驚訝的是,她不但在手術中康復了過來,而且現在,她還想繼續實現她的夢想——去做個芭蕾舞演員。Rasmussen是一位歐洲醫生的名字,因為他最早確診了這種疾病。Rasmussen's腦炎多見於剛出生到14歲內的青少年兒童,是罕見的中樞神經系統疾病。該病全世界報導的僅有300多例。
Rasmussen腦炎(RE)臨床少見,但症狀嚴重。該病病因至今不明,目前資料提示是由免疫介導的腦功能障礙導致的單側腦半球萎縮,臨床表現為進行性神經系統功能障礙和難治性癲癇。RE的診斷依據臨床、腦電圖和MRI,部分患者還需進行組織病理學檢查。治療目的是減少癲癇發作和阻止進行性神經系統損傷。
RE是一種特異性進行性疾病,主要見於小兒。臨床表現為逐漸加重的局部性運動性癲癇發作,常發展為持續性部分性癲癇(epilepsiapartialiscontinua,EPC),抗癲癇藥物不能滿意控制發作。病程中逐漸發生偏癱和進行性認知障礙。病理特點是一側大腦半球限局性慢性炎症。病因不明,近年的研究認為RS的發病與自身免疫機制有關。
到目前為止,所有的研究均未發現病毒,也未分離出病毒,卻發現病變腦組織及腦血管存在自身免疫性損害,並發現在患者體記憶體在谷氨酸受體(glur3)的抗體。有人對1例glur3抗體濃度較高的患者進行血液換置治療,以降低glur3的濃度。癲癇發作頻率及程度出現明顯改善。從目前獲得的研究結果來看,人們更傾向於稱本病為rasmussen綜合徵,有關rasmussen綜合徵的病因,仍然是需要人們深入研究的問題之一。
病理病因
 2009年3月13日在海淀區北京三博腦科醫院門外,“半腦”男孩依偎在父親懷裡。男孩父親介紹,兒子患有Rasmussen's腦炎,在醫院做了多次手術。
2009年3月13日在海淀區北京三博腦科醫院門外,“半腦”男孩依偎在父親懷裡。男孩父親介紹,兒子患有Rasmussen's腦炎,在醫院做了多次手術。根據蒙特利研究所的經驗,RE病者的病理特徵分為下列數級:①最早期患者表現為炎性反應,有許多膠質結節,伴或不伴神經元吞噬,血管周圍有圓細胞和膠質瘢痕形成。②病程稍久則見到許多膠質結節,血管周圍出現袖套現象和圓細胞浸潤,至少有一個灰質塊完全壞死。③表現神經細胞喪失,中等膠質細胞增生,血管周圍有豐富的圓細胞,極少有膠質結節。④最終,見不到膠質結節,有神經元喪失和輕度血管周圍炎性變化,伴有程度不等的膠質細胞增生和膠質瘢痕形成。
2004年Pordo等用定量免疫組化技術研究顯示,在增生的膠質小結和激活的星形細胞,主要是T細胞,在許多CD3+的CD8+細胞中包涵有GRB+顆粒,而且有7%的CD8+細胞附在神經元附近,而神經元則表達MHC-I型抗原陽性。許多神經元由凋亡而死亡。但病毒感染的包涵體沒有見到。
本病為散發的罕見疾病,1958年Rasmussen提出此病,並認為可能的病因為病毒感染,但是至今尚無可靠證據證實。證實本病的免疫病因,包括體液和細胞毒性T細胞反應的可靠資料不斷出現。20世紀90年代以來,在部分患者血清中測到興奮性胺基酸—谷氨酸受體3(GluR3)的抗體,並在兔子中注射GluR3溶合蛋白後引起癲癎發作,但近年的研究否定了該結果。細胞免疫研究亦見到與GluR3有關的細胞毒性免疫反應和病理中見到腦內淋巴細胞浸潤。2003年Nabbout和Dulac等提出Rasmussen腦炎作為一種癲癎腦病,認為癲癎發作可以破壞血腦屏障,引起體液和細胞免疫反應,從一側影響到兩側的腦組織而致腦組織異常。
RS的病因尚未完全清楚,現多認為是一種自身免疫性疾病。曾提出可能為RS病因的假說有慢性持續性病毒感染、急性病毒感染誘發局部免疫反應、自身免疫疾病等。由於RS的腦病理與慢性腦炎相同,故提出慢性病毒性腦炎的可能,但在過去30餘年中,雖然作出不懈努力以尋找RS腦組織內病毒物質的存在,均未能成功。只有Power等(1990)對10例RS用巨細胞病毒DMA探針檢查,發現7例有CMV基因組物質。但其他學者在Rs腦標本中均未見到巨細胞病毒、單純皰疹病毒、傳染性單核細胞增生症病毒等任何病毒物質。說明病毒不是RS的病因,至少不是唯一的病因。是否病毒感染誘發特殊的遺傳素質或出現異常的免疫反應,有待進一步研究。
關於免疫反應的問題,Andrews等(1990)發現RS病兒血清中抗核抗體增高,腦脊液中有寡克隆帶及內源性IgG生成,腦組織有慢性炎症及IgG、IgM、IsA、C3、C1q等免疫複合物沉積,證明免疫反應的存在。同時也顯示,腦皮層的免疫性病理改變可以引起臨床癲癇發作。
發病機制
 疾病患者(右)開心的半頭兒還不知今後的艱難。
疾病患者(右)開心的半頭兒還不知今後的艱難。 RE的自身免疫學說,由Rogers等(1994)的一系列研究得到證明。作者們用谷氨酸受體亞單位3(GluR3)對兔進行免疫時,發現兔的癲癇發作和腦的病理改變與人類RS相似,因而推測RS是針對GluR3蛋白的自身免疫病。隨後,作者們在3例活動性RS病兒的血清中發現了抗GluR3的自身抗體,證明抗GluR3自身抗體是RS的發病原因。如果確實如此,則用血漿置換法濾除血循環中的抗GluR3抗體,應使症狀減輕。作者遂對1例RS病兒進行了血漿置換,結果在其循環抗體減少的同時,臨床也顯著好轉。
雖然血漿置換的效果是一過性的,但可以認為,GluR3是自身抗原,而抗GluR3抗體是引起RS的神經元脫失、慢性炎症和癲癇發作的主要原因。正常時,血腦屏障(BBB)阻止抗體進入腦組織,但RS時有BBB的局部缺損,抗GluR3抗體可以通過BBB到達腦細胞的谷氨酸受體,導致腦的免疫性損傷。抗GluR3抗體激活了興奮性神經遞質谷氨酸的受體,使神經元興奮而引起癲癇發作;發作本身又使BBB產生裂隙,使更多的抗體和免疫炎性細胞進入腦內,加重免疫反應,形成惡性循環,導致臨床的進行性惡化病程。Rogers的臨床研究(Twyman等,1995)又進一步證明,抗GluR3抗體不僅可以辨認谷氨酸受體並與之結合,還能對谷氨酸受體起到激動劑的作用。
這是首次發現特異抗體可以激動一個神經遞質的受體。由於抗體對谷氨酸受體的過度刺激而引發臨床癲癇發作。GluR3受體有A和B兩型,抗GluR3A抗體可以與受體結合,但不能激活該受體;而抗GluR3B抗體不但可以與受體結合,還激活谷氨酸受體離子通道活性,並損傷甚至殺死神經元。其結果是:由於抗體的激動作用,引起受體過度刺激,谷氨酸產生過多,產生興奮性毒性作用(excitotoxicity),導致神經元損傷直至死亡。這種神經元死亡是通過補體還是通過凋亡機制尚有不同意見。Krauss等(1996)報導l例Rs,用環磷醯胺效果較好,但並未測到抗GluR3抗體;加之有些RS病理除慢性腦炎之外,還可見其他病變,說明RS的病因仍需進一步證明。
RE時的嚴重癲癇發作,原因較複雜。根據上述GluR3自身免疫學說,發作是由於興奮性神經遞質谷氨酸過多所致。RS的雙重病理,如結節性硬化、神經元移行缺陷等,也可引起癲癇發作及損傷血腦屏障。對癲癇的遺傳易感性也不能排除。此外,癲癇發作本身所致腦損傷也使病情惡化。
臨床表現
 治療中的卡梅倫
治療中的卡梅倫本病最初的症狀是局部性癲癇發作,起病年齡平均約為7歲(14個月~14歲),10歲以內者占80%。也可起病於少年(13~14歲)或成人,但少見。在癲癇發作以前,發育多為正常,無外傷史;數月之內有急性炎症性疾病者少見。一般沒有免疫疾病史。病程為進行性,癲癇逐漸加重,並出現偏癱和認知障礙,臨床經過與腦內由限局性慢性炎症發展為炎症腦萎縮的的病理改變過程相符合。Andermann(1991)對48例RS做了總結。病初的癲癇發作形式主要是局部性運動性發作,約占80%;偶有放電的泛化而表現為全身強直陣攣發作。少數病例(約20%)以全身性發作開始,但在病程中仍以局部性發作為主要的發作形式。抽動的部位主要見於口角、眼瞼、手指或前臂,為振幅不大的快速陣攣。有時可見Jaeksonian發作,由VI角抽動逐漸波及上肢,或波及半身。發作頻繁,56%表現為持續性部分性癲癇(EPC),持續數小時、數日、數月或更長。從初次癲癇發作到出現EPC之間的間隔時間不定,一般是1~2年。約21%的病例發生全身性驚厥持續狀態。
病程進行的速度各例不同,由數月至數年、數十年不等。最終都發展為持續性癲癇發作、偏癱、認知缺陷和行為異常,Et常生活受到嚴重影響。可以將全部病程大致分為三期,但其間並無嚴格界線。第一期以進行性癲癇發作為主要表現,尚未出現永久性偏癱和認知障礙。此期對於多數有EPC的病例來說,診斷較易;對於沒有EPC的病例,可根據逐漸加頻而藥物不能控制的部分運動性發作而疑及RS。第二期開始於起病後3個月至10年不等,多在5年以內,出現進行性偏癱。偏癱可能是發作後暫時癱瘓的積累,也可能與發作無關,是腦病理改變直接引起的後果。認知缺陷、智力衰退見於85%以上的病例,其程度各不相同。17%有性格改變和行為異常。此外還有大腦半球其他功能受損的表現,如失語(18%),偏盲(49%),軀體感覺障礙(29%),構音障礙(23%),以及視覺障礙、舞蹈樣不自主動作等。此期持續時間從2個月至10年不等。第三期病情相對穩定,發作頻率減少或停止,但仍處於癱瘓和智力衰退狀態。
近年報導RS可起病於少年和成人(Han等,1997)。少年期(13~16歲)開始的RS,臨床和病理特徵與10歲以下兒童相似,但病程經過較良性,EPC較少,而較多見枕葉病理改變和視覺症狀,如幻視、偏盲等。有的病理改變較限局。成人起病的RS與少年起病者相似,較良性,有的沒有認知障礙。該作者認為,少年和成人Rs在手術治療方法上與兒童RS有區別,不一定做半球切除,只做腦病灶的限局性切除即可。
RE主要是一種起病於兒童期的,較少見的嚴重疾病,並未由腦組織直接分離出病毒,用PCR等方法曾檢出的可疑觸發因素有:巨細胞包涵體病毒、皰疹病毒和EB病毒等。當初Rasmussen等只是根據腦組織中有淋巴細胞浸潤及小膠質細胞結節形成等類似俄羅斯春夏季腦炎的病理改變,推論為某種免疫反應所致的腦炎。有關的免疫機制已知有2種。體液性自身免疫;由T淋巴細胞介導的細胞毒性反應,但是無論是體液免疫,細胞免疫或兩者並存,均不足以解釋RE僅累及一側大腦的特點,Andrew等推測系由於驚厥本身可以損傷該側大腦的血腦屏障,導致相關抗體或免疫活性細胞侵入,進一步加重驚厥發作,形成惡性循環所致。臨床表現為各種發作形式的癲癇、進行性的偏癱及智力減退為Rasmussen’s綜合徵三大主征。它約占所有癲癇病因中的1%。RE主要在兒童期發病,平均起病年齡為6歲。典型病例可分為3期。
1、初始期:平均病程7個月,主要表現為並不頻繁的癲發作,腦影像學檢查可無特殊發現,有的病例此期可長達數年,部分病例無初始期,直接進入急性期。
2、急性期:癲發作頻繁,主要呈持續性癲部分性發作(epilepsiapartialiscontinua,EPC),伴有進行性一側肢體運動障礙、偏盲、認知功能降低,若主側半球受累可同時有失語,此期平均病程4~8個月。此期的癲發作有以下特點:①發作表現形式可以多樣;②最常見的形式為EPC;③對抗癲藥反應差。究其原因,Andermann及Rasmussen認為是致灶遊走於大腦半球不同部位所致。
3、後遺症期:癲發作頻率可有所減少,與持續的神經系統殘障表現(如偏癱)同時存在,此期腦影像學檢查可有明顯的、常為一側性的腦病變和腦萎縮。
診斷
 可愛的卡梅倫曾因患有Rasmussen綜合徵而不得不接受手術治療——切除半個大腦。
可愛的卡梅倫曾因患有Rasmussen綜合徵而不得不接受手術治療——切除半個大腦。RS診斷是根據臨床表現和腦病理改變。臨床的3個主要症狀是進行性癲癇發作、偏癱和認知障礙,但尚需實驗室檢查的確診。RS時腦脊液可為正常,或有少量淋巴細胞和輕度蛋白增高。腦電圖檢查可見背景活動慢化,或有δ波爆發,多為雙側性異常,以一側為主,90%兩側不對稱。發作間期可見瀰漫性、以一側為主的棘波灶,以額、顳區為著。約45%有兩側同步、頻繁的不規則棘慢波,雜以多形慢波。也可在一側前頭部有持續性高幅節律性慢活動,夾雜棘波。腦電圖改變與臨床的進行性惡化有一定相關,晚期出現嚴重的一側性腦萎縮時,健側的異常可能更為突出。發作期腦電圖很難判定放電的起始部位,可為一側開始,或為多灶性開端;腦電圖放電與臨床發作的相關性有時並不明顯。必要時需做腦皮質活檢以顯示特殊的病理改變。
RE的診斷主要依賴於病史,臨床典型的癲癎發作和發病過程,腦電圖異常和頭顱MRI的陽性發現。Derry等(2002)指出,若能符合下列標準A的3條或B的2條,RE即可診斷。
A:①臨床上有局灶性癎性發作(伴或不伴部分連續發作和一側皮質缺損)。②腦電圖示一側半球慢波,伴或不伴癎樣電活動和一側癎性發作。③MRI顯示一側局灶性皮質萎縮,至少是灰質或白質在T2/Flair上有高信號,同側尾狀核頭部高信號或萎縮。
B:①臨床上有癲癎部分連續發作(EPC)或一側進行性皮質性功能缺失。②MRI可見進行性一側皮質萎縮。③病理:T-細胞為主的腦炎伴激活的膠質細胞和反應性星形細胞增多,或腦實質內有許多巨噬細胞或漿細胞或可除外RE的病毒包涵體。
臨床上,在診斷RE過程中仍需與顱內占位病變,一側半球癲癎綜合徵,代謝性或進行性變性神經疾病,特別是MELAS等相鑑別。還需與中樞神經的其他炎症性疾病相鑑別如腦血管炎、亞急性硬化性全腦炎、俄國春夏腦炎及多發性硬化等相鑑別。
針對RE的診斷,文獻報導不一。有關谷氨酸受體-3(GluR3)抗體對RE的輔助診斷價值,在諸多文獻中受到置疑,目前很難確定其在RE診斷中的作用和地位。還有學者認為,RE的診斷主要依靠臨床症狀學、電生理學和影像學的系列隨訪檢查,個別病例可能需要組織病理學確診。
早在2002年,國外學者對RE的病期進行了詳細描述和分期。初期階段平均為7.1個月,該期內的臨床症狀主要為頻率很低、發作較輕的部分運動性發作,罕見偏癱;急性期主要表現為頻繁發作的部分運動性抽搐,約69%的患者可出現部分性發作持續狀態(EPC)和偏癱,平均持續約8個月;到了末期,癲癇發作次數減少,但偏癱和神經功能障礙則比較固定。
由此可見,對末期的RE診斷比較容易。如何對早期的RE做出確診,除了重點、綜合觀察臨床症狀、MRI的進行性改變外,免疫抑制劑對早期RE均有較好的治療效果也可作為一個參考依據。
結合病例,病程最短者僅4個月即明確診斷。其確診主要建立在典型的臨床症狀學和進行性左側半球皮質萎縮的基礎上。均可得到較理想的治療。
鑑別診斷
 9歲的卡梅倫-莫特在經歷了一個大手術後被去除了半個大腦,但是,小女孩不但活了下來,並且十分堅強地聲稱會繼續追求夢想。
9歲的卡梅倫-莫特在經歷了一個大手術後被去除了半個大腦,但是,小女孩不但活了下來,並且十分堅強地聲稱會繼續追求夢想。RS需要與許多疾病鑑別,如伴有持續性部分性癲癇的疾病、腦皮質發育不良、腦灰質變性、朊蛋白病、慢病毒感染、海綿樣腦病、線粒體腦病(MELAS)、腦錯構瘤等。
神經影像學檢查有助於確定局部病變的性質、範圍、病情進展情況及治療效果的判定。CT可見腦萎縮現象(腦室擴大,以顳角最著,外側裂增寬)。MRI對早期診斷有幫助,常可見顳葉內側病變,據認為,小兒頻繁局部性運動性發作,加上MRI早期表現,就應考慮RS的可能(1998)。SPECT也對早期診斷有幫助,有時比MRI更早發現顳葉血流低灌注區,為早期治療提供依據。
SPECT還可發現在EEG放電最大的區域有血流灌注增加,同時在治療後隨著臨床好轉缺血性影像也明顯好轉,顯示治療的有效性。PET檢查可見受累半球有限局性葡萄糖代謝率減低。MRS(磁共振光譜)可早期發現腦損傷,在MRI尚未顯示異常時即可發現神經元損傷及脫失,此外,還證明局部乳酸堆積是EPC的後果而不是由於RS本身。RS需要與許多疾病鑑別,如伴有持續性部分性癲癇的疾病、腦皮質發育不良、腦灰質變性、朊蛋白病、慢病毒感染、海綿樣腦病、線粒體腦病(MELAS)、腦錯構瘤等。
兒童Rsmussen腦炎首次影像檢查多表現正常。隨著時間推移,MR上可見腦皮質和皮層下白質內出現長T2信號灶;隨後,發生腦萎縮。額葉和顳葉為最常受累部位,且島葉皮質常可見萎縮。約65%患兒可見基底節進行性T2信號延長和萎縮。質子MRS圖像顯示,受累白質的NAA峰減低。如採用短回波序列,則可見谷氨酸/谷氨醯增高,可能因癲癇持續發作所致。18F-脫氧葡萄糖PET檢查顯示大腦半球病變區葡萄糖攝取降低。病變區彌散度增加,也許因病變區細胞丟失和萎縮所致。
年齡為1-15歲(最常見於3和6歲)既往身體健康的兒童如出現單純部分性癲癇發作頻率增加,且可見發作後損傷,即使神經影像檢查顯示正常,也應考慮Resmussen腦炎。
疾病檢查
實驗室檢查
15%的患者腦脊液檢查異常,有輕度腦脊液細胞增多,16~17×106/L白細胞,輕度腦脊液蛋白增高(500~1000mg/L),部分患者可有單克隆IgG陽性。血清抗GluR3抗體測定常無肯定結果,其他檢查正常。
其他檢查
腦電圖檢查可見一側半球,特別是顳葉局灶性δ波,有癎樣放電,但有時腦電圖正常。頭顱MRI檢查,可見腦室擴大,一側島葉和島周圍區擴大,皮質和皮質下異常信號,重則半球萎縮伴同側尾核頭部萎縮。
疾病治療
 RASMUSSEN腦炎
RASMUSSEN腦炎RS的對症治療,即控制持續性部分性癲癇和其他類型的難治性癲癇發作,曾試用過各種抗癲癇藥物,均未得到滿意效果。
RS的病因治療也較複雜。根據病因的不同學說,提出了各種不同的治療方法。主張病毒感染者,用各種抗病毒藥物,如無環鳥苷(Acyclovir)、齊多夫定(zidovudine)、更昔洛(gancidovir)等,均未見確實效果。
免疫抑制劑的效果尚無結論,如激素、ACTH、環磷醯胺等。但多數認為仍可以試用,其作用機理可能是抗癲癇、保護血腦屏障、或抗炎作用。治療方法舉例:先靜脈注入甲基強的松龍400mg/m2,隔日一次,共3次;然後13服強的松2mg/kg·d,持續套用3~24個月,在此期間逐漸減量。有人認為套用數月後可以使發作減少,神經症候好轉,對於病程在15個月以內者,效果較好。此外,腦室內注入a干擾素似有一些效果。目前認為,在針對特異性自身抗體的治療尚未推廣施行之前,比較有效的方法有靜脈注射丙種球蛋白、血漿置換、外科手術。
靜脈注射丙種球蛋白(IVIG)治療RS是Walsh(1991)首先提出的。Hart等(1994)用大劑量MG單用或與激素合用,治療19例RS,療效不一致,有好轉,也有無效者。Wise等(1996)、Martland等(1997)在其他方法治療無效後,開始IVIG,劑量為400ms/ks.d,5天為一療程,每2~4個月重複一個療程,結果滿意。Martland等對6歲病兒在起病3個月後開始WIG,在完成第二個療程後症狀好轉,發作停止,輕偏癱恢復。Wise等對14歲病兒在起病後6個月開始MG,共做了12個療程,歷時3年10個月,病情穩定,發作減少,偏癱停止進行,認知和社會適應功能良好,患者完成了中學課程,並進入大學。其腦電圖和MRI仍保留額區的限局性異常。此病兒的臨床進行性病程和腦病理(腦組織活檢)都確定RS的診斷。ⅣIG治療未見不良反應,其作用機理可能是阻斷內源性抗體的合成,缺點是價格昂貴。
血漿置換的治療方法是根據RS的自身免疫機理提出的(Andrews等,1996),目的是將血中抗GluR3抗體濾除。血漿置換後,病兒發作減少80%,認知、語言也有明顯改善,但數周或數月後有可能復發。一般認為血漿置換尤其適用於病程急劇惡化或癲癇持續狀態時。
外科手術被認為是在未找到特異性病因治療的情況下,唯一能使發作停止的方法。手術進行越早,病程越短,年齡越小,效果越好,可使病兒生活質量改善,防止由於持續性癲癇發作造成的認知功能下降,也可避免抗癲癇藥物的不良反應。以前多做局部病灶切除,效果不滿意,癲癇容易復發。現多行一側大腦半球切除,或次全切除,可以使發作和智力倒退中止進行(Rasmussen,1983,1989)。優勢半球切除術時應注意到語言功能的問題,儘量防止術後失語的發生。對小年齡患兒,優勢和非優勢半球分化尚不完全,健側半球可逐步代償被切除半球的語言和運動等功能。功能性半球切除術是當前採用的方法,該方法切除患側額葉後部、中央區、頂葉前部及全部顳葉,切斷殘存額葉和頂枕區之間的連線,同時行胼胝體全部切斷。功能性大腦半球切除術在解剖學為半球次全切除,但在生理上可達到大腦半球全切除的效果,並可避免腦表面含鐵血黃素沉積症等手術合併症。無論如何,外科手術還不能認為是本病最終的治療方法,針對RS的自身免疫機制尋找更好的預防和干預方法是當務之急。
手術療效分析
 疾病患者
疾病患者一、一般情況
本組病例中,男性6例,女性7例;年齡3歲8個月-24歲,平均10歲3個月;發病年齡3歲-16歲4個月,平均6歲5個月;病程4個月-15年,平均4年5個月。發作類型主要為單純部分運動性發作(10例)和部分繼發全身性發作(5例),5例出現頻繁的癲癇持續狀態。4例患兒在發病前1月內有感冒發熱史。就診時11例患者有不同程度的肢體運動功能障礙。神經心理功能粗測:6例智慧型低於同齡兒童。
二、手術前綜合評估
1、視頻腦電圖(V-EEG):所有患者均行頭皮V-EEG監測,監測時間20-48h,平均28h。在監測中均捕捉到5次以上的癲癇發作。其中5例捕捉到癲癇持續狀態。腦電圖特徵:在發作期和發作間期,1例(No.6)為局限性的Rolandic區域棘波發放;2例為患側半球以中央頂為主的棘慢波放電;2例為雙側半球均有棘波和棘慢波,但以病變側半球為主;3例為額顳部的棘慢波;2例為患側顳區的棘慢波;3例為患側半球的瀰漫性慢波和健側半球額顳部的棘波。
2、磁共振成像(MRI)和正電子發射計算機斷層掃描(PET):所有患者均有2次以上的MRI檢查,病變部位主要在顳葉、額葉的灰質及灰白質交界處。12例患者為一側半球皮層的進行性萎縮;1例(No.4)患者雙側半球皮層均有萎縮,以左側半球為主。4例患者在行PET檢查,可見患側半球表現為瀰漫性低代謝改變。
3、Wada試驗、功能磁共振成像(f-MRI):為測定半球功能,結合每例患者的臨床症狀,2例(No.2、6)行Wada試驗,1例(No.5)行f-MRI檢查。Wada試驗測試的內容包括語言、記憶、運動和腦電圖改變等4大項。受試的2位患者分別為17歲的青少年和21歲的成人,均為左側半球病變,其記憶、運動功能尚在;病例6語言功能抑制明顯,病例2被部分抑制;腦電圖改變均出現於注藥後3-5秒內,最初均表現為被測試半球額顳部的δ慢活動,隨之擴散到同側半球的頂枕部和對側半球。腦電圖的改變先於臨床症狀的抑制。病例5為一名8歲男性,f-MRI未見患側半球運動功能的明顯缺失,語言功能位於左側半球。
4、顱內電極植入後腦電圖監測(i-EEG):病例6為21歲的在校大學生,儘管病史長達3年余,MRI可見左顳、額皮質進行性萎縮。但肢體運動等功能未見明顯異常。綜合非侵入性檢查結果,在左側Rolandic’s區域放置4*8柵狀電極後再進行腦電圖監測,發現癲癇放電起源於右手指支配區周圍。
三、手術方法的選擇:根據手術前的綜合評估結果,RE的手術方法主要包括下述三種。
1、大腦半球切除術:本組病例共有9例患者行大腦半球切除手術。其中3例行Adame’s改良術式解剖性半球切除(No.7、8、10),6例行Rasmussen’s術式功能性半球切除(No.1、3、4、5、9、13)。
2、多腦葉切除術:病例2是一名的17歲男性,經Wada試驗測試,其運動功能未見明顯受損。手術行大腦半球開顱,在皮質腦電圖監測下切除萎縮、壞死的顳葉、部分額葉和顳枕葉。同時對功能區放電進行BEFC手術。
3、致癇皮質“tailor”切除術:病例6通過植入柵狀電極後再進行腦電圖監測,確定致癇區位於Rolandic區域。結合其具體情況行局部皮質“tailor”切除術。同時對周圍異常放電區域進行BEFC手術。
4、大腦半球纖維離斷術:本組有2例病人行此術式(例11、12),切除病變側顳葉及海馬結構,全段切開胼胝體,並將病變側額、頂、枕與丘腦的纖維聯繫全部切斷。
結果
一、術中所見和病理:病變部位的灰質減少、白質質地變韌,尤以島葉的額蓋、顳蓋部位明顯。血供與正常腦組織比較,無明顯改變。側腦室內脈絡叢增生。手術後病理可見,膠質細胞增生,血管壁旁有白細胞和淋巴細胞浸潤(圖4、5)。
二、癲癇控制情況:在6-53個月的隨訪期內,8例患者一直無癲癇發作(No.1、3、7、9-13);2例患者出現1-2次發作,但發作程度減輕、時間縮短(No.5、8);2例患者發作次數明顯減少、發作程度減輕(No.4、6);1例患者僅發作程度減輕(No.2)。
三、神經心理功能情況:隨著癲癇發作的控制,手術後患者的神經心理狀況也有不同程度改善。10例患者的記憶功能好於術前,3例患者的語言功能有較大改善。值得一提的是,在5例左側半球切除術的病例中,2例語言功能無明顯受損,1例經3個月的恢復,能進行日常生活用語交流。
四、肢體功能情況:手術後9例患者出現對側肢體偏癱;1例肌力下降(No.4);3例無明顯變化(No.1、2、6)。經康復訓練等綜合治療後,10例患者的肢體運動功能明顯改善,可完成與其年齡相當的簡單功能。2例患者可自如行走,但手指功能恢復慢。
五、併發症:2例患者出現顱內感染,1例患者因頭皮下積液反覆抽吸3次並加壓包紮後痊癒。
討論
RE最早由Rasmussen於1958年報導。這是一種病因不明的慢性、進行性中樞神經系統疾病。它好散發於14個月到14歲(平均為6.8歲,高峰期為早期學齡期)的兒童,青春期和成人則少見。
針對RE的診斷,文獻報導不一。有關谷氨酸受體-3(GluR3)抗體對RE的輔助診斷價值,在諸多文獻中受到置疑,目前很難確定其在RE診斷中的作用和地位。C.G.Bien等認為,RE的診斷主要依靠臨床症狀學、電生理學和影像學的系列隨訪檢查,個別病例可能需要組織病理學確診(具體標準見表-2)。
早在2002年,C.G.Bien就對RE的病期進行了詳細描述和分期。初期階段平均為7.1個月,該期內的臨床症狀主要為頻率很低、發作較輕的部分運動性發作,罕見偏癱;急性期主要表現為頻繁發作的部分運動性抽搐,約69%的患者可出現部分性發作持續狀態(EpilepsiapartialiscontinuaEPC)和偏癱,平均持續約8個月;到了末期,癲癇發作次數減少,但偏癱和神經功能障礙則比較固定。
由此可見,對末期的RE診斷比較容易。如何對早期的RE做出確診,除了重點、綜合觀察臨床症狀、MRI的進行性改變外。C.G.Bien認為,免疫抑制劑對早期RE均有較好的治療效果也可作為一個參考依據。結合本組病例,病程最短者(No、1)僅4個月即明確診斷。回顧分析該病例,其確診主要建立在典型的臨床症狀學和進行性左側半球皮質萎縮的基礎上。還有3例患者在發病初期就診即明確診斷,以後均得到了較理想的治療。
RE的誘發因素和臨床發作特點,文獻已有詳細報導。在本組病例中,4例患者在發病前1周到1月內有感冒發熱史,其餘4例無明確病因。發病初期,癲癇發作可有多種發作形式,但多局限於一側而表現為部分性發作。和Jackson癲癇不同的是,RE引起的部分性發作多從面部開始,待面部抽動停止後再出現手的症狀,隨後是下肢、肩部等。每次發作都突然開始、突然停止。這種發作表明一個局部病灶的點燃往往不會引起擴散,下一次發作多從非關聯部位重新開始。這樣,發作症狀和範圍逐漸擴大直至出現一側肢體的偏癱。以後則會頻繁出現EPC發作和肢體偏癱。該特點已在本組病例1、3、4、7中得到了充分驗證。
MRI表現為一側半球皮質的進行性萎縮,在本組的每個病例均表現的非常明顯。ChiappariniL曾詳細描述了RE的MRI特點。在發病最初的4個月內,大部分患者表現為島葉或外側裂區域的間隙擴大,皮質或皮質下(T2/FLAIR)信號增高,同側尾狀核頭部信號增高;而少部分患者可表現為局灶性皮質腫脹。隨後,在受累側半球則會出現以島葉、外側裂為中心,向周圍皮質擴散的進行性萎縮和擴大的異常信號範圍。但是,也曾觀察到少數病例的患側半球皮質無進行性萎縮的情況,儘管有典型的臨床症狀學表現。
RE一旦診斷明確,就確定了該類患者藥物難治性的可能。RE幾乎對所有的抗癲癇藥物耐藥,但大劑量皮質激素、丙種球蛋白、血漿置換等可能有一定緩解作用。如果頻繁癲癇發作不能控制或皮質功能明顯受損,早期外科手術可能有助於減輕患者痛苦。兒童患者的早期手術,還會促發受損半球功能的轉移,有利於提高患者的長期生活質量。對那些功能受損不明顯或年齡偏大,手術後可能出現明顯功能缺損的患者,可採取類似病例2、7的手術方式,待時機成熟再行半球手術。這裡需要強調的是,手術後一定要進行系統的功能康復鍛鍊。
研究進展
中國治療“特殊腦炎”領先世界(健康關注)
(彭雁)一種被稱為“特殊腦炎”(Rasmussen腦炎)的兒童期慢性中樞神經系統的難治疾病,已被中國專家攻克——北京三博腦科醫院首席專家劉興洲、欒國明教授已成功治癒20餘例。兩位教授在近日舉行的第四屆北京三博國際神經科學論壇上,發表的臨床學術報告得到來自美、日、法等國的7位專家的充分肯定與高度讚揚,稱其已達到世界最先進水平。
據介紹,Rasmussen腦炎於1958年見於臨床,患者年齡為18個月至5歲,臨床表現為逐漸加重的局部性運動性癲癇發作,常發展為持續性部分性癲癇並逐漸發生偏癱和進行性認知障礙。病理特點是一側大腦半球限局性慢性炎症,病因不明,研究認為與自身免疫機制有關,目前全球已發現300餘例。
欒教授表示,他於1998年開展了首例“特殊腦炎”手術治療,至今已經先後治癒20餘例,占全球患者的6%。劉興洲教授提供的癲癇腦電圖定位及“內外科聯合干預”治療難治性癲癇報告也引起與會專家的關注,並向該院推薦國外病人。據知,該院已接診來自哈薩克斯坦等中亞地區外籍病人幾十例。
本屆國際神經科學論壇是由中國抗癲癇協會、首都醫科大學北京三博腦科醫院、中國醫師協會神經調控專業委員會聯合主辦的。通過本次會議,北京三博癲癇中心將與克里夫蘭癲癇中心、日本靜岡國立癲癇中心等建立長期學術合作關係。
