鹼金屬原子光譜
正文
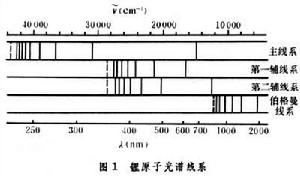
鋰、鈉、鉀、銣、銫等元素的光譜。這些光譜具有相似的結構,光譜線也明顯地分成幾個線系。通常觀察到的有主線系、第一輔線系(漫線系)、第二輔線系(銳線系)和伯格曼線系(基線系)。圖1畫出了鋰原子光譜的四個線系。從圖中可以看到主線系的波長範圍最寬、第一條是紅色的,其餘的都在紫外。線系限是229.97nm;第一輔線系在可見光區部分;第二輔線系的第一條在紅外區,其餘在可見光區,這二線系有同一線系限,伯格曼線系在紅外區,其他鹼金屬原子也有相似的光譜線系,只是波長不同,例如鈉的主線系的第一條線是大家熟悉的黃色光,波長為589.3nm。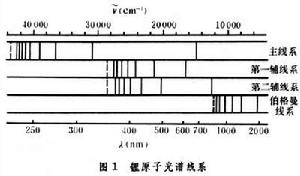 鹼金屬原子光譜
鹼金屬原子光譜鹼金屬原子的能級公式與氫原子相似:
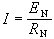
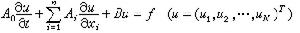 Z*稱為有效核電荷數。以鋰為例,四個線系公式為
Z*稱為有效核電荷數。以鋰為例,四個線系公式為 主 線 系
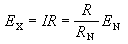
第一輔線系
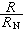
第二輔線系
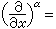
伯格曼線系
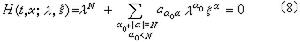
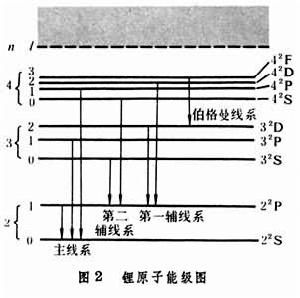
其他鹼金屬原子的線系公式也相似。圖2是鋰原子的能級和光譜線系的示意圖。
 鹼金屬原子光譜
鹼金屬原子光譜鹼金屬原子譜線的雙重結構是由於電子自鏇與軌道運動相互作用的結果,電子的自鏇角動量等於
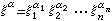 即自鏇量子數s=1/2。又由於電子自鏇角動量相對於軌道角動量只可能有兩個取向,故電子的總角動量量子數
即自鏇量子數s=1/2。又由於電子自鏇角動量相對於軌道角動量只可能有兩個取向,故電子的總角動量量子數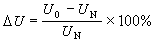 鹼金屬原子在滿充殼層外面只有一個價電子,滿充殼層的總角動量為零,所以價電子的總角動量就等於原子的總角動量。
鹼金屬原子在滿充殼層外面只有一個價電子,滿充殼層的總角動量為零,所以價電子的總角動量就等於原子的總角動量。 與自鏇的兩種取向相對應,電子自鏇與軌道相互作用造成了能級分裂為二,所以鹼金屬原子的光譜項是雙層的,對於Л=0,1,2,3,…的S,P,D,F,…項用符號2S┩,2P┩,2D崰,2D嵻,…表示,其中左上角角標2表示能級的層數,右下角角標表示j值,理論計算表明,鹼金屬原子的雙層能級間的間隔可用波數表示為
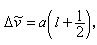
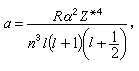
 隨n、Л的增加而減少,隨Z*的增加而很快地增加,這都與實驗觀察相符合。
隨n、Л的增加而減少,隨Z*的增加而很快地增加,這都與實驗觀察相符合。 原子光譜是由於電子在不同能級之間的躍遷而產生的。根據輻射躍遷的選擇定則:ΔЛ=±1,Δj=0,±1。因此鹼金屬原子的各光譜線系可表示如下:
主 線 系
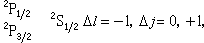
第二輔線系
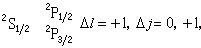
第一輔線系
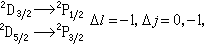
伯格曼線系
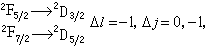
其中箭頭表示兩能級之間的躍遷,即產生一條光譜線。箭頭左端表示上能級,其n值是變化的;右端表示下能級,其n值是固定的。例如對於鋰的主線系,右端應為22S┩,即鋰的基態n=2;鈉的基態n=3。鈉原子的能級和躍遷過程如圖3所示。
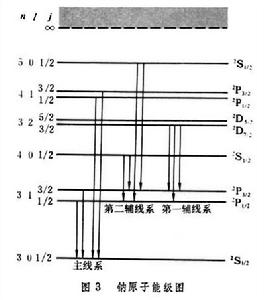 鹼金屬原子光譜
鹼金屬原子光譜鹼金屬光譜的超精細結構可參見原子光譜的超精細結構。