簡介
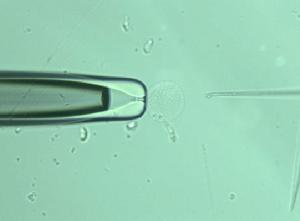 顯微注射法
顯微注射法顯微注射法又稱DNA原核顯微注射法,即通過顯微操作儀將外源基因直接用注射器注入受精卵,利用外源基因整合到DNA中,發育成轉基因動物。其創始人是Jaenisch和Mintz等。Gordon等和Palmiter等先後通過此方法獲得轉基因動物。此方法目前套用較普遍,現在的轉基因動物研究大都是在Palmiter等方法的基礎上有所改進而進行的。
用顯微注射法轉移抗瘟病毒核酸酶基因,獲得了轉基因兔。KrimPenfort運用體外培養胚胎再施用顯微注射法獲得了轉基因牛。
上述方法主要適用於一些卵殼易被胰蛋白酶消化的淡水鯉科魚類。對於一些冷水性的鮭鱒魚類來說,胰蛋白酶消化難以去除卵殼。因此發展了3種變通的顯微注射方法。一是從受精孔將DNA溶液注入卵中,簡稱MP法;二是在虹鱒受精卵剛受精後卵殼尚未變硬時直接注射,簡稱EL法;三是先用硬金屬針在卵殼上打一個孔,再進行顯微注射,簡稱LI法。
歷史沿革
顯微注射法這種方法是1981年由美國科學家戈登(Gordon)等人首先實驗成功的。他們將小鼠的受精卵取出來,在顯微鏡下將胸苷激酶基因用玻璃微管送入受精卵的雄原核,然後立刻輸入假孕母鼠的輸卵管中,使其在子宮內著床,最終發育成轉基因小鼠。在此後約一年多時間內,人的珠蛋白基因和胰島素基因也被轉入了小鼠。
隨後,生產轉基因小鼠的經驗迅速地被移植到生產轉基因家畜上。到1985年,哈默(Hammer)等人首先報導用顯微注射法生產出轉基因兔、羊和豬。顯微注射雖然是有效的方法,但轉基因動物生產仍是一項困難的技術,即使具備了良好的設備和訓練有素的技術人員,注射和移植一百個小鼠胚胎,僅能獲得五隻轉基因小鼠。家畜的胚胎細胞核不易看清,不能直接注射,必須先作離心處理後才能注射,這樣,生產轉基因個體的機率又下降了一個數量級。
魚類和兩棲類的卵是多黃卵,在顯微鏡下不易辨認原核,有些科學家採用基因注入卵母細胞核的方法,因為卵母細胞核大些,可以在顯微鏡下看見,基因可以注入卵母細胞核中,讓卵母細胞體外成就並受精,最終受精卵發育成小魚。
特點
這種方法的特點是外源基因的導入整合效率較高,不需要載體,直接轉移目的基因,目的基因的長度可達100Kb。它可以直接獲得純系,所以實驗周期短。但需要貴重精密儀器,技術操作較難,並且外源基因的整合位點和整合的拷貝數都無法控制,易造成宿主動物基因組的插入突變,引起相應的性狀改變,重則致死。
以小鼠受精卵雄原核的顯微注射為例,顯微注射所使用的受精卵固定吸管(holdingpipette)及注射針(injectionneedle)製備很困難,除影響操作時間外,也是影響轉基因效率及基因注入後之胚胎存活及轉基因成功與否極其重要的因子。固定吸管之內、外徑分別為30、80μm是較為合適的,顯微注射針自針尖起20μm處的外徑為4μm時,可獲得良好的轉染效率。固定吸管的內徑如果太小,會導致吸力不足,對受精卵操控不易;如太大,則受精卵易受傷害,影響胚胎的存活率。
顯微注射針尖如果太粗,則導致插入透明帶及原核的阻力增加,且DNA流量過多,受精卵易於裂解;太細則導致針內DNA流出速率過慢,且易阻塞,而使DNA無法順利流入原核內,影響注射效率。因此進行受精卵雄原核的顯微注射時,如何製備適用固定受精卵的吸管及顯微注射針是關乎轉基因效率極其重要的因素。
相關轉基因方式
1、轉基因動物
以顯微注射法轉外源基因沒有長度上的限制,目前已證明數百kb之DNA片段均可以成功產制出轉基因動物。其缺點是設備精密而昂貴、操作技術需要長時間的練習,以及每次只能注射有限的細胞。這些操作中所使用的微量移液管是用毛細管拉針器(pipettepuller)來製作的,先將玻璃毛細管加熱到其熔化的溫度,再將其拉製成所需的合適大小的直徑和錐形,微量移液管小頭的直徑(小至0.2微米)與纖維操縱器的高精度相關,它可以用於精準的移液。
這種精確度可以為各種類型和任意大小的細胞提供亞皮克升級或0.1微米(micron)範圍內的精確的、重複性良好的細胞內和細胞旁註射。通過運用直接的水壓(壓力注射)或者不通過使用水流,而通過施加一電場來使帶電離子運動(離子電滲法),都可以獲得將微量移液管中的物質擠噴出去的效果。
2、轉基因方式
目前最常用來生產轉基因動物的方式為:直接把重組過的DNA注入授精卵的原核(pronuleus)中,將從胚胎提供者的輸卵管中取得的授精卵移到倒置顯微鏡上的微量注射台上,然後利用固定吸量管(holdingpipette)固定住,之後注射針則依序穿過zonapellucida,ocytemembrane及malepronuleusmembrane後,將DNA注入,注入時可以見到原核膨大。以小鼠受精卵雄原核的顯微注射為例,顯微注射所使用的受精卵固定吸管(holdingpipette)及注射針(injectionneedle)製備很困難,除影響操作時間外,也是影響轉基因效率及基因注入後之胚胎存活及轉基因成功與否極其重要的因子。
固定吸管之內、外徑分別為30、80μm是較為合適的,顯微注射針自針尖起20μm處的外徑為4μm時,可獲得良好的轉染效率。固定吸管的內徑如果太小,會導致吸力不足,對受精卵操控不易;如太大,則受精卵易受傷害,影響胚胎的存活率。顯微注射針尖如果太粗,則導致插入透明帶及原核的阻力增加,且DNA流量過多,受精卵易於裂解;太細則導致針內DNA流出速率過慢,且易阻塞,而使DNA無法順利流入原核內,影響注射效率。因此進行受精卵雄原核的顯微注射時,如何製備適用固定受精卵的吸管及顯微注射針是關乎轉基因效率極其重要的因素。
主要程式
(1)人工催情,分別收集魚的卵子和精液,體外人工受精;
(2)受精後3~5min,用0.25%的胰蛋白酶消耗以去除卵殼,將裸卵移入盛有Holtfreter氏培養液的平面皿中;
(3)將溶於ST(88mMNaCl、10mMTris—HCl,pH7.5)溶液中的外源基因裝人玻璃微針,在第一次卵裂前實施外源基因的顯微注射手術。每卵注射1—2nL的DNA溶液,約含1×106拷貝的外源基因;
(4)顯微注射後,受體卵在Holffreter氏溶液中培養發育。胚胎髮育至原腸期後,將培養液逐漸用暴氣的冷開水稀釋;發育至心跳期後,將胚胎轉移到暴氣的冷開水中直至形成魚苗。在胚胎髮育過程中,需精心管理,及時去除死胚胎。
這種顯微注射術的程式,需有相當精密的顯微操作設備,製造長管尖時,需用微量吸管拉長器(micropipettepuller),注射時需有固定管尖位置的微量操作器。這種技術的長處為任何DNA在原則上均可傳入任何種類的細胞內。此法已成功運用於包括小鼠、魚、大鼠、兔子及許多大型家畜,如牛、羊、豬等基因轉殖動物。
以顯微注射法轉外源基因沒有長度上的限制,目前已證明數百kb之DNA片段均可以成功產制出轉基因動物。其缺點是設備精密而昂貴、操作技術需要長時間的練習,以及每次只能注射有限的細胞。這些操作中所使用的微量移液管是用毛細管拉針器(pipettepuller)來製作的,先將玻璃毛細管加熱到其熔化的溫度,再將其拉製成所需的合適大小的直徑和錐形,微量移液管小頭的直徑(小至0.2微米)與纖維操縱器的高精度相關,它可以用於精準的移液。
這種精確度可以為各種類型和任意大小的細胞提供亞皮克升級或0.1微米(micron)範圍內的精確的、重複性良好的細胞內和細胞旁註射。通過運用直接的水壓(壓力注射)或者不通過使用水流,而通過施加一電場來使帶電離子運動(離子電滲法),都可以獲得將微量移液管中的物質擠噴出去的效果。
實驗程式
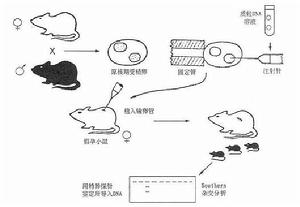 顯微注射法簡化的實驗過程
顯微注射法簡化的實驗過程 ⑴準備假孕母鼠(養母):將可育雌鼠與輸精管結紮後絕育的雄鼠交配,剌激雌鼠發生一系列妊娠變化而得到假孕母鼠作為受精卵轉基因後的養母;
⑵受精卵的準備:可育雌鼠注射孕馬血清與絨毛膜促性腺激素(HCG)促使超排卵。處理後與可育雄鼠交配。次日從輸卵管內收集受精卵備用;
⑶基因導入:用顯微注射裝置將目的基因溶液導入受精卵雄性原核內;
⑷胚胎移植:將已轉入基因的受精卵自背部植入假孕母鼠的輸卵管內,使胚胎在養母體內發育成熟;
⑸對幼鼠的鑑定:①幼鼠發生斷乳後自尾部提取DNA,與目的基因探針作分子雜交,鑑定外源基因是否整合,有整合的鼠稱為首建鼠(founder);②建立鼠系,將帶有外源基因的小鼠與未經轉基因的小鼠交配、傳代後,後代有50%機率帶有整合的基因供實驗用。也可將合適的組織進行細胞培養建立細胞系;③自小鼠內臟提取RNA,與目的基因探針做分子雜交,比鑑定外源基因的表達和表達的組織特異性。表達產物可以測定活性的,也可直接自血液或組織測定活性蛋白質,常用的方法如酶聯免疫吸附試驗(ELISA)或放射免疫測定(RIA)等。亦可取胚胎進行分析。中國已有少數實驗室(如中國醫學科學院基礎醫學研究所)套用此法進行載脂蛋白TGM研究。
套用
顯微注射法是目前廣泛使用、效果較好的一種魚類基因導人方法,目前最常用來生產轉基因動物的方式為:直接把重組過的DNA注入授精卵的原核(pronuleus)中,將從胚胎提供者的輸卵管中取得的授精卵移到倒置顯微鏡上的微量注射台上,然後利用固定吸量管(holdingpipette)固定住,之後注射針則依序穿過zonapellucida,ocytemembrane及malepronuleusmembrane後,將DNA注入,注入時可以見到原核膨大。
在畜牧獸醫中的套用
套用於動物抗病育種轉基因技術可以用於動物抗病育種,通過克隆特定基因組中的某些編碼片段,對之加以一定形式的修飾以後轉人畜禽基因組,如果轉基因在宿主基因組能得以表達,那么畜禽對該種病毒的感染應具有一定的抵抗能力,或者應能夠減輕該種病毒侵染時對機體帶來的危害。其用於遺傳育種,不僅可以加速改良的進程,使選擇的效率提高,改良的機會增多,並且不會受到有性繁殖的限制。例如Berm將抗流感基因Mx轉入豬;Clements等將Visna病毒(綿羊髓鞘脫落病毒)的表殼蛋白基因(Eve)轉入綿羊,獲得的轉基因動物抗病力明顯提高;丘才良把一種寒帶比目魚抗凍基因(AFP)成功地轉移到大西洋鮭中,為提高某些魚類的抗寒能力做了積極的嘗試。
套用於動物生產通過轉基因技術,可以促進動物生長、提高畜產品產量、改善品質。繼Palmiter將大鼠GH基因導入小鼠基因組得到巨型小鼠之後,牛、綿羊以及人的GH基因也先後導入小鼠基因組,得到的轉基因小鼠在快速生長期(5-11周)生長速度達到對照組小鼠的4倍。外源GH調節生長的機理被認為是可以刺激宿主動物胰島素樣生長因子的合成與分泌。
1996年,紐西蘭科學家關於轉基因綿羊羊毛產量增加的報導吸引了不少同行的目光。Damak等將小鼠超高硫角蛋白啟動子與綿羊的IGF-IcDNA融合基因顯微注射到綿羊原核期胚胎,移植後生出5隻羔羊,其中兩隻(一公一母)為轉基因陽性。用轉基因羊與43隻母羊交配,生出85隻羔羊,其中43隻(50.6%)為轉基因陽性。羔羊在14月齡剪毛時,轉基因羊淨毛平均產量比其半同胞非轉基因羊提高了6.2%,公羔羊產毛量提高的幅度(9.2%)高於母羊3.4%)。在毛纖維直徑、髓質以及周歲體重方面無明顯差別。
在醫學領域中的套用
建立診斷和治療人類疾病的動物模型在動物轉基因技術問世以前,發現自然突變體幾乎是遺傳學家獲得遺傳疾病模型的唯一途徑。目前,遺傳學家可以通過精確地失活某些基因或增強某些基因的表達來製作各種各樣的研究人類疾病的動物模型,也可以為研究諸如AIDS這樣的疾病提供合適的動物模型。
Yu等將突變的人甲狀腺受體基因與β-肌動蛋白基因啟動乾融合後轉入小鼠的基因組,以研究這種突變可能的結果。其研究結果表明,陽性小鼠體型普遍小,生長遲緩,眼睛睜開的時間晚,部分陽性小鼠眼睛眯縫,眼球小。其中一隻陽性小鼠在6月齡時眼睛瞎了,此外,轉基因陽性小鼠與對照組小鼠相比壽命都短,多於11一12月齡時死亡。這一系列的結果為診斷乃至治療人類類似的疾病積累了寶貴的資料。
用於生產藥用蛋白用轉基因動物的乳腺生產重組蛋白(乳腺生物反應器)可能是轉基因動物的最大套用,這也是世界範圍內轉基因研究的熱點之一。Swamdom(1992)用β-球蛋白的4個核酸酶I的高敏位點與人的兩個基因相連,融合基因產生的轉基因豬與鼠的原型相似。Sham(1994)用同源性豬-球蛋白的基因做啟動子連線入β-球蛋白基因編碼區,在轉基因豬中高效表達出人的血紅蛋白。
目前,把轉基因動物當作生物反應器來生產藥用蛋白已經受到國際社會的極大關注,不僅各國政府投資,一些私人集團也不惜投入大量資金加以研究和開發。
生產可用於人體器官移植的動物器官異源器官移植可能是解決世界範圍內普遍存在的器官短缺的有效途徑,目前對器官供體動物研究較多的是豬。豬作為人類器官移植的供體動物有以下一些優勢:妊娠期短,產仔數多,後代生長快,而且不存在倫理方面的問題。更重要的是豬的不同發育時期的器官,諸如心臟、腎等與不同年齡的人的器官在大小上比較接近,極有可能代替病人的某些器官。
利用脂質體轉染成功地將LXSN—CD59轉入豬血管內皮細胞,獲得表達CD59蛋白克隆細胞,發現其表達的CD59蛋白對人體補體有調節作用。White博士等人的研究結果和最近Kroshus,Miyagawa等人的研究表明,攜帶人類免疫系統基因的轉基因豬作為人類異種器官移植供體的前景美好,方法可行。
