成份
 速萊
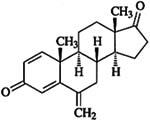
速萊本品主要成份為依西美坦,其化學名為6-甲烷基雄甾-1,4-二烯-3,17-二酮。
其結構式為:
分子式: CHO
分子量: 296.41
性狀
本品為白色或類白色片或薄膜衣片,除去包衣後顯白色或類白色。
適應症
適用於以他莫昔芬治療後病情進展的絕經後晚期乳腺癌患者。
規格
25mg
用法用量
一次一片(25mg),一日一次,飯後口服。輕度肝腎功能不全者不需調整給藥劑量。
不良反應
本品主要不良反應有:噁心、口乾、便秘、腹瀉、頭暈、失眠、皮疹、疲勞、發熱、浮腫、疼痛、嘔吐、腹痛、食慾增加、體重增加等。其次文獻報導還有高血壓、抑鬱、焦慮、呼吸困難、咳嗽等。其他還有淋巴細胞計數下降、肝功能指標(如丙氨酸轉移酶等)異常等。在臨床試驗中,只有3%的病人由於不良反應終止治療,主要在依西美坦治療的前10周內;由於不良反應在後期終止治療者不常見(0.3%)。
禁忌
對本品或本品內賦形劑過敏的患者禁用。
注意事項
絕經前的婦性一般不用依西美坦片劑。依西美坦不可與雌激素類藥物連用,以免出現干擾作用。
中、重度肝功能、腎功能不全者慎用。超量服用依西美坦可使其非致命性不良反應增加。
運動員慎用。
孕婦及哺乳期婦女用藥
禁用。
兒童用藥
禁用。
老年用藥
無特別的注意事項。
藥物相互作用
本品不可與雌激素類藥物合用,以免拮抗本品的藥效作用;依西美坦主要經細胞色素P4503A4(CYP3A4)代謝,但其與強效的CYP3A4抑制劑(酮康唑)合用時,本品的藥動學未發生改變,因此似乎CYP同工酶抑制劑對本品的藥動學無顯著影響。但不排除已知的CYP3A4誘導劑降低血漿中依西美坦濃度的可能性。
null
藥物過量
在健康女性志願者中進行了高達800mg單劑量的臨床試驗;在絕經後晚期乳腺癌婦女中進行了高至600mg/日共12周的臨床試驗,這些劑量下受試者耐受性良好。
藥物過量時無特殊解毒劑,應當進行一般的支持護理,如:經常檢查生命體徵以及密切觀察病人等。
藥理毒理
藥理作用 乳腺癌細胞的生長可依賴於雌激素的存在,女性絕經期後循環中的雌激素(雌酮和雌二醇)主要由外周組織中的芳香酶將腎上腺和卵巢中的雄激素(雄烯二酮及睪酮)轉化而來。通過抑制芳香酶來阻止雌激素生成是一種有效的選擇性治療絕經後激素依賴性乳腺癌的方法。依西美坦為一種不可逆性甾類芳香酶滅活劑,結構上與該酶的自然底物雄烯二酮相似,為芳香酶的偽底物,可通過不可逆地與該酶的活性位點結合而使其失活(該作用也稱“自毀性抑制”),從而明顯降低絕經婦女血液循環中的雌激素水平,但對腎上腺中皮質類固醇和醛固酮的生物合成無明顯影響。在高於抑制芳香酶作用濃度的600倍時,對類固醇生成途徑中的其他酶不產生明顯影響。
毒理研究
單次給藥毒性:小鼠單次經口給藥劑量達3200mg/kg(按體表面積計算,約為人臨床推薦劑量的640倍)時,出現死亡。大鼠和犬單次劑量分別為5000mg/kg和3000mg/kg(按體表面積計算,分別約為人臨床推薦劑量的2000倍和4000倍)時,動物出現死亡。小鼠和犬單次給藥劑量分別達400mg/kg和3000mg/kg(按體表面積計算,分別約為人臨床推薦劑量的80倍和4000倍)時,動物出現驚厥。
臨床研究中,健康人本品單次給藥劑量達800mg/kg及晚期乳腺癌患者劑量高達600mg連續給藥12周時,均表現出良好的耐受性。
生殖毒性:交配前14天至妊娠15-20天內,大鼠給予本品,泌乳期繼續給藥21天,其劑量為4mg/kg/日(按體表面積計算,相當於人臨床推薦劑量的1.5倍)時,出現胎盤重量增加;劑量大於或等於20mg/kg/日時,出現妊娠期延長、分娩異常或困難,同時也觀察到吸收胎增加、活胎數減少、胎仔重量降低、骨化延遲。妊娠大鼠器官形成期給藥劑量小於或等於810mg/kg(按體表面積計算,約為人臨床推薦劑量的320倍)時,未出現明顯致畸胎作用。家兔器官形成期給藥劑量90mg/kg/日(按體表面積計算,約為人推薦臨床劑量70倍)時,出現胎盤重量降低;劑量為270mg/kg/日時,出現流產、吸收胎增加和胎兔體重降低;劑量小於或等於270mg/kg/日(按體表面積計算,約為人推薦臨床劑量的210倍)時,家兔畸形率未見增加。目前尚無本品對孕婦影響的臨床研究資料,若妊娠期服用本品,應告之患者本品對胎兒的潛在危害性和出現流產的潛在危險。
交配前63天及合籠期間,雄性大鼠給藥500mg/kg/日(按體表面積計算,約為人臨床推薦劑量的200倍)時,可使與之交配的未給藥雌性大鼠的生育力降低。本品劑量為20mg/kg/日(按體表面積計算,相當於人臨床推薦劑量的8倍)時,對雌性大鼠的生育力參數(如卵巢功能、交配行為、受孕率)無影響,但使平均窩仔數降低。另外,在一般毒性研究中,按體表面積計算,給藥量為人推薦劑量的3-20倍時,小鼠、大鼠及犬均不同程度地出現卵巢改變,包括過度增生、卵巢囊腫數增多及黃體數減少。
大鼠經口給予放射標記的14C-依西美坦1mg/kg後,發現其可通過胎盤,給藥後15分鐘在乳汁中出現帶放射活性的依西美坦,上述劑量下,單次給藥後24小時,本品及其代謝物在母體與胎兒血液中的濃度相當。尚不知本品是否通過人乳汁分泌。因許多藥物可經乳汁分泌,故哺乳期婦女應慎用本品。
遺傳毒性:本品在Ames試驗和V79中國倉鼠肺細胞試驗中未表現出致突變作用。在體外無代謝活化的情況下,對人淋巴細胞表現出致突變作用,但小鼠微核試驗結果陰性。本品不增加大鼠肝細胞的程式外DNA合成。
致癌性:目前尚無本品致癌作用的研究資料。
藥代動力學
據文獻報告,絕經的健康女性口服放射標記的依西美坦後,吸收迅速,至少42%的依西美坦在胃腸道被吸收;食用高脂肪餐後;其血漿水平上升約40%。依西美坦在各組織中廣泛分布,其血漿蛋白結合率為90%。依西美坦的代謝率廣泛,主要通過6-位亞甲基的氧化和17-位酮基還原進行代謝,代謝產物無活性或抑制芳香酶活性較弱,其代謝物主要從尿和糞中排泄,約各占40%左右、尿中排出的原形藥物低於給藥量的1%。依西美坦的平均終末半衰期為24小時。乳腺癌晚期絕經後女性的吸收較健康絕經女性快,達峰時間分別為1.2小時和2.9小時。重複給藥後,乳腺癌晚期患者的平均口服清除率較健康絕經女性低45%,而循環中的水平較高;其平均AUC較健康女性高約2倍。
中或重度肝腎功能不全者,單次口服依西美坦後的AUC較健康志願者高3倍。
貯藏
遮光、密封保存。
包裝
鋁塑包裝,14片/板。
有效期
24個月
執行標準
WS1-(X-010)-2006Z
批准文號
國藥準字H20020002
生產企業
齊魯製藥有限公司
核准日期
2007年04月10日
修訂日期
2007年12月27日
