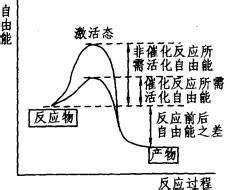
名稱概述
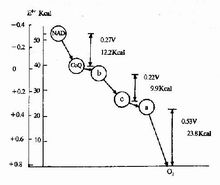 呼吸鏈中電子對傳遞時自由能的變化
呼吸鏈中電子對傳遞時自由能的變化自由能(free energy)在物理化學中,按照亥姆霍茲的定容自由能F與吉布斯的定壓自由能G的定義,G=A+PV (P為壓力,V為體積)。在生物的反應中,因為△(PV)可以忽略不計,所以兩者是相同的。只有這樣,A的變化△A=△U-T△S才成為主要討論的問題(U、T、S分別是該系統的內能、絕對溫度、熵)。△A給出了生物反應中釋放出來可用於做功的能量上限。其變化量(一般用△G*表示)在生物學上使用時必須注意下列事項:⑴水的活度,可隨意設為1.0進行計算:⑵因[H+]=1M並不符合實際情況,一般認為[H+]=10^(-7) M(pH=7),為了區別其符號寫成△G0′;⑶例如反應,因各種成分並非標準濃度(1M),把實際濃度代入下式後其值△G′就有問題了;⑷在共軛反應中,要注意各種成分反應的變化量之和;⑸把△G0改為用平衡常數
(Keq)表示,往往是很有用的。
分類
亥姆霍茲自由能
 亥姆霍茲
亥姆霍茲設體系從溫度為T環的熱源吸取熱量δQ,根據第二定律的基本公式
dS-δQ/T環≥0;
代入第一定律的公式δQ=dU十δW,得
δW≤-(dU-T環ds)
若體系的最初與最後溫度和環境的溫度相等,即T1=T2=T環,則
δW≤-d(U-Ts) (2.27)
令 F===U-TS (中間橫線上為def) (2.28),F稱為亥姆霍茲自由能(Helmholz free energy),亦稱亥姆霍茲函式,又稱為功函(work function),它顯然是體系的狀態函式。由此可得
δW≤-dF (2.29a)
或 W≤-DF (2.29b)
此式的意義是,在等溫過程中,一個封閉體系所能做的最大功等於其亥姆霍茲自由能的減少。因此,亥姆霍茲自由能可以理解為等溫條件下體系作功的本領。這就是把F叫做功函的原因。若過程是不可逆的,則體系所做的功小於亥姆霍茲自由能的減少(此處等溫並不意味著自始至終溫度都保持恆定,而是指只要環境溫度T環不變,且Tl=T2=T環)。還應注意,亥姆霍茲自由能是體系的性質,是狀態函式,故DF的值,只決定於體系的始態和終態,而與變化的途徑無關(即與可逆與否無關)。但只有在等溫的可逆過程中,體系的亥姆霍茲自由能減少(-DF)才等於對外所做的最大功。因此利用式(2.29a)或(2.29b)可以判斷過程的可逆性。
自式(2.29b)還可以得到一個重要的結論。若體系在等溫等容且無其他功的情況下,則-DF≥0,式中等號適用於可逆過程,不等號適用於自發的不可逆過程,即在上述條件下,若對體系任其自然,不去管它,則自發變化總是朝向亥姆霍茲自由能減少的方向進行,直到減至該情況下所允許的最小值,達到平衡為止。體系不可能自動地發生DF>0的變化。
利用亥姆霍茲自由能可以在上述條件下判別自發變化的方向,這就是亥姆霍茲自由能又叫做等溫等容位的原因。根據式(2.29b),在等溫可逆情況下,-DF=Wmax,,體系亥姆霍茲自由能的減少等於對外所做的最大功。
吉布斯自由能
如何判斷在一個封閉系統內是否發生一個自發過程?吉布斯自由能就是這樣一個狀態函式之一,而卻是最常用的一種:封閉系統在等溫等壓條件下可能做出的最大有用功對應於狀態函式——吉布斯自由能(有時簡稱自由能或吉布斯函式,符號為G)的變化量。
△G=W′max
有上標加上的“′”的W′通指有用功,下表max則是表示它的絕對值達到最大值。
對於化學反應,它的吉布斯自由能的變化量△G可以通過電化學方法測得,即:
△G=nFE
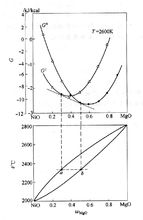 液相和固相吉布斯自由能隨組成的變化曲線
液相和固相吉布斯自由能隨組成的變化曲線其中E為原電池的電動勢,上式表明,若電動勢為E時向外電路釋放n mol電
子,電池的吉布斯自由能的變化量△G(≡G終態-G始態)就等於-nFE。
吉布斯自由能是過程自發性的判斷,它的大小相當於系統向環境作最大可能的有用功,因此,我們也可以說,吉布斯自由能是系統做有用功的本領度量,也就是系統過程自發性的度量。不過不要忘記,我們前面已經明確,吉布斯自由能用以度量系統作最大有用功的條件是系統內發生的過程是等溫等壓過程。若發生等溫等容過程或其他過程,需要另作別論。
做功
有人可能會問:為什麼單單用等溫等壓過程系統向環境作最大有用功的能力而不用包括氣體膨脹功在內的總功來度量系統發生自發過程的可能性呢?原因在於,系統發生自發過程,膨脹功是可正可負的。可見單單考慮系統作有用功,排除了膨脹功,問題才更純,更明確。
總之,在等溫等壓條件下系統自發過程的判斷是:
△G<0
即:△G<0,過程自發;△G>0,過程不自發(逆過程自發);△G=0,達到平衡態。一個自發過程,隨著過程的發展,△G的絕對值漸漸減小,過程的自發性漸漸減弱,直到最後,△G=0,達到平衡。
換算
對於一個化學反應,可以像給出它的標準摩爾反應焓△rHmΘ一樣給出它的標準摩爾反應自由能變化△rGmΘ(為簡潔起見,常簡稱反應自由能)。
跟熱力學能變△U、焓變△H隨溫度與壓力的改變不會發生大的改變完全不同,反應自由能△rGm隨溫度與壓力的改變將發生很大的改變。因此,從熱力學數據表中直接查出或計算出來的298.15K,標態下的△rGmΘ(298.15K)的數據,不能用於其它溫度與壓力條件下,必須進行修正。
用熱力學理論可以推導出,求取T溫度下的氣體壓力對△rGmΘ的影響的修正公式為:
J=∏(pi/pΘ)vi
其中∏是算符,表示連乘積(例如,a1×a2×a3=╥ai;i=1,2,3),pΘ為標態壓力=100kPa,pi為各種氣體(與△rGm(T)對應)的非標態壓力,vi是化學方程式中各氣態物質的計量係數,故J是以計量係數為冪的非標態下各氣體的分壓與標準壓力之比的連乘積。
若系統中還有溶液,上式應改為:
J=∏(pi/pΘ)Vi·∏(ci/cΘ)Vi
若系統中只有溶液,則上式又應改為:
J=∏(ci/cΘ)Vi
對大多數化學反應而言,溫度對反應自由能的影響要大大超過反應物的分壓(以及濃度)對反應自由能的影響。通過實驗或熱力學理論計算,可以得出各種反應的自由能受溫度的影響情形。若以反應的標準摩爾自由能△rGmΘ為縱坐標,以反應溫度作為橫坐標,可以形象地看出溫度怎樣影響一個反應的標準自由能(如右圖所示)
從圖中可以看出,有的反應的自由能隨溫度升高而增大,有的則減小,曲線的斜率也不盡相同,而且,實驗與理論推導都證實,自由能隨溫度的變化十分接近線性關係,當溫度區間不大時,作線性化近似處理不會發生太大偏差,相當於把圖中的曲線拉直。藉助這種近似處理可以得到溫度對反應自由能影響的線性方程:
△rGmΘ=a+bT
a直線在縱坐標上的截距,b是直線的斜率。熱力學理論推導了這個方程的截距和斜率,證實截距恰為反應焓△rHmΘ,斜率恰為另一狀態函式S的變化值△S的負值(△rSmΘ):
△rGmΘ=△rHmΘ-T△rSmΘ
術語和符號的含混
歷史上,對“自由能”這一術語的使用在不同學科中存在不同。
化學當中,自由能指的是吉布斯自由能,以G表示,同時稱亥姆霍茲自由能為“亥姆霍茲函式”,以示區別。
物理學當中,自由能指的亥姆霍茲自由能,以F表示,同時稱吉布斯自由能為“吉布斯函式”,以示區別。
現在,一般以G表示吉布斯自由能,以A表示亥姆霍茲自由能,避免使用F。