簡介
在生化研究工作中,常常需要使用緩衝溶液來維持實驗體系的酸鹼度。研究工作的溶液體系pH值的變化往往直接影響到研究工作的成效。如果“提取酶”實驗體系的pH值變動或大幅度變動,酶活性就會下降甚至完全喪失。所以配製緩衝溶液是一個不可或缺的關鍵步驟。
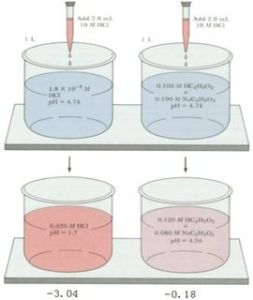
緩衝溶液是無機化學及分析化學中的重要概念,緩衝溶液的pH值在一定的範圍內不因稀釋或外加少量的酸或鹼而發生顯著的變化,緩衝溶液依據共軛酸鹼對及其物質的量不同而具有不同的pH值和緩衝容量。分析測試中,在絡合滴定和分光光度法等許多反應里都要求溶液的pH值保持在一個範圍內,以保證指示劑的變色和顯色劑的顯色等,這些條件都是通過加入一定量的緩衝溶液達到的,所以緩衝溶液是分析測試中經常需要的一種試劑。 採用電位滴定法測定外加酸或鹼對不同配比同一種緩衝溶液的滴定曲線,不僅有助於理解緩溶液及緩衝容量的概念而且對分析測試中正確選緩衝溶液的配製方法及用量具有指導意義。
採用電位滴定法測定緩衝溶液的滴定曲線,選擇 了常見的NH。-NH C1緩衝溶液,分別按照不同的配 比得到4種緩衝溶液,實驗測定了強酸、強鹼對緩衝 溶液的滴定曲線,滴定結果直觀清晰,對理解緩衝容 量的概念及實踐中緩衝溶液的選擇有積極的意義。
組成
緩衝體系由
1、弱酸和它的鹽(如HAc---NaAc)
2、弱鹼和它的鹽(NH·HO---NHCl)
3、多元弱酸的酸式鹽及其對應的次級鹽(如NaHPO---NaHPO)
的水溶液組成。
配製
只要知道緩衝對的PH值,和要配製的緩衝液的pH值(及要求的緩衝液總濃度),就能按公式計算[鹽]和[酸]的量。這個算法涉及對數換算,較麻煩,前人為減少後人的計算麻煩,已為我們總結出pH值與緩衝液對離子用量的關係並列出了表格。只要我們知道要配製的緩衝液的pH,經查表便可計算出所用緩衝劑的比例和用量。例如配製500nmpH5.8濃度為0.1M磷酸緩衝液。
經查表知pH5.8濃度為0.2M Na2HPO48.0毫升,而0.2M Na2HPO492.0毫升。依此可推論出配製100ml0.1M的磷酸緩衝液需要0.1M Na2HPO48.0毫升,而0.1M Na2HPO4需要92.0毫升。
計算好後,按計算結果準確稱好固態化學成分,放於燒杯中,加少量蒸餾水溶解,轉移入50ml容量瓶,加蒸餾水至刻度,搖勻,就能得到所需的緩衝液。
各種緩衝溶液的配製,均按表格按比例混合,某些試劑,必須標定配成準確濃度才能進行,如醋酸、氫氧化鈉等。另外,所有緩衝溶劑的配製計量都能從以上的算式準確獲得。
PH影響
設緩衝系統的弱酸的電離常數為Ka(平衡常數),平衡時弱酸的濃度為[酸],弱酸鹽的濃度為[鹽],則由弱酸的電離平衡式可得下式:
[H+] = Ka {[弱酸]/[共軛鹼]}
pH = pKa + lg {[共軛鹼]/[弱酸]}
這就是Henderson-Hasselbach 等式。
如果[弱酸] = [共軛鹼],則
pH =pKa
根據此式可得出下列幾點結論:
1 緩衝液的pH值與該酸的電離平衡常數Ka及鹽和酸的濃度有關。弱酸的pKa值衡定,但酸和鹽的比例不同時,就會得到不同的pH值。酸和鹽濃度相等時,溶液的pH值與PKa值相同。
2 酸和鹽濃度等比例增減時,溶液的pH值不變。
3 酸和鹽濃度相等時,緩衝液的緩衝效率為最高,比例相差越大,緩衝效率越低,緩衝液的一般有效緩衝範圍為pH=pKa+-1,pOH=pKb+-1。
相關舉例
 緩衝溶液
緩衝溶液常用作緩衝溶液的酸類由弱酸及其共軛酸鹽組合成的溶液具有緩衝作用。生化實驗室常用的緩衝系主要有磷酸、檸檬酸、碳酸、醋酸、巴比妥酸、Tris(三羥甲基氨基甲烷)等系統,生化實驗或研究工作中要慎重地選擇緩衝體系,因為有時影響實驗結果的因素並不是緩衝液的pH值,而是緩衝液中的某種離子。如硼酸鹽、檸檬酸鹽、磷酸鹽和三羥甲基甲烷等緩衝劑都可能產生不需要的化學反應。
硼酸鹽:硼酸鹽與許多化合物形成復鹽、如蔗糖。
檸檬酸鹽:檸檬酸鹽離子容易與鈣結合,所以存在有鈣離子的情況下不能使用。
磷酸鹽:在有些實驗,它是酶的抑止劑或甚至是一個代謝物,重金屬易以磷酸鹽的形式從溶液中沉澱出來。而且它在pH7.5以上時緩衝能力很小。
三羥甲基氨基甲烷:它可以和重金屬一起作用,但在有些系統中也起抑制作用。其主要缺點時溫度效應。這點往往被忽視,在室溫pH是7.8的Tris緩衝液,4℃時是8.4,37℃時是7.4,因此,4℃配製的緩衝液在37℃進行測量時,其氫離子濃度就增加了10倍。在pH7.5以下,其緩衝能力極為不理想。
CO2緩衝液
在高中生物中,光合作用實驗裡,CO2緩衝液有吸收CO2的能力,控制變數。
人體血漿里最重要的緩衝體系是碳酸氫鹽緩衝體系是:
H2CO3= H+ + HCO3﹣
pH= pKa + lg〔HCO3﹣〕/〔H2CO3〕
在正常血漿中,〔HCO3﹣〕︰〔CO2〕= 20︰1
pH=6.10+lg20/1=7.40
人體各組織、細胞代謝產生的CO2,主要通過血紅蛋白和氧合血紅蛋白的運輸作用,被迅速運到肺部排出,故幾乎不影響血漿的pH,當產生比CO2酸性更強的酸(如磷酸、硫酸、乙酸等)時,血液中HCO3﹣/ CO2緩衝對便發揮緩衝作用,其中HCO3-可與代謝產生或外合產生CO2和H2O。增加的CO2大部分從肺部排出或通過血漿中蛋白質緩衝對和與之作用,,使〔CO2〕降低;減少的HCO3﹣可通過腎臟進行調節而得到補充,從而使
〔HCO3﹣〕,〔CO2〕和〔HCO3﹣〕/〔CO2〕都恢復正常。當人體新陳代謝過程中產生的鹼進入血液時,血液中的H3O+便立即與它結合生成水。H3O+的消耗有H2CO3的解離來補充,結果也使血液的pH 保持穩定。
常用緩衝液配製
枸櫞酸-磷酸氫二鈉
甲液:取枸櫞酸21g或無水枸櫞酸19.2g,加水使溶解成1000ml,置冰櫃內保存。
乙液:取磷酸氫二鈉71.63g,加水使溶解成1000ml。
取上述甲液61.45ml與乙液38.55ml,混合,搖勻,即得。
氨-氯化銨緩衝液
取氯化銨1.07g,加水使溶解成100ml, 再加稀氨溶液(1→30)調節pH值至8.0,即得。
氨-氯化銨緩衝液
取氯化銨5.4g,加水20ml溶解後,加濃氨溶液35ml,再加水稀釋至100ml,即得。
醋酸-醋酸鈉緩衝液
取無水醋酸鈉20g,加水300ml溶解後,加溴酚藍指示液1ml及冰醋酸60~80ml,至溶液從藍色轉變為純綠色,再加水稀釋至1000ml,即得。
醋酸-醋酸鈉緩衝液
取醋酸鈉18g,加冰醋酸9.8ml,再加水稀釋至1000ml,即得。
醋酸-醋酸鈉緩衝液
取醋酸鈉54.6g,加1mol/L醋酸溶液20ml溶解後,加水稀釋至500ml,即得。
醋酸-醋酸銨緩衝液
取醋酸銨7.7g,加水50ml溶解後,加冰醋酸6ml與適量的水使成100ml,即得。
醋酸-醋酸銨緩衝液
取醋酸銨77g,加水約200ml使溶解,加冰醋酸57ml,再加水至1000ml,即得。
醋酸-醋酸銨緩衝液
取醋酸銨100g,加水300ml使溶解,加冰醋酸7ml,搖勻,即得。
磷酸鹽緩衝液
取0.2mol/L磷酸二氫鉀溶液250ml,加0.2mol/L氫氧化鈉溶液118ml,用水稀釋至1000ml,即得。