基本介紹
符號:HCO3-
碳酸氫根既顯酸性又顯鹼性
化合價:-1價
化合價計算:(+4)x1【碳】+(-2)x3【氧】+(+1)x1【氫】= -1
簡介
碳酸氫根在生理學上也有很重要的作用,血液中含有H2CO3-HCO3-組成的緩衝溶液,以抵禦大幅度的pH值變化,為酶等生物分子維持適宜的酸鹼度。
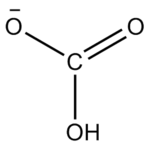 碳酸氫根離子的結構
碳酸氫根離子的結構碳酸氫根離子的結構。碳酸氫根(HCO3−)為平面結構,碳位於中心,與三個氧原子鍵連。它是碳酸的共軛鹼,也是碳酸根離子的共軛酸。水溶液中存在下列平衡,碳酸氫根既可發生電離生成水合氫離子,也會水解出氫氧根離子,水解程度大於電離,因此水溶液呈弱鹼性。
CO + 2 HO ⇋ HCO + HO + OH ⇋ HCO + 2 OH H2CO3 + 2 H2O ⇋ HCO3 + H3O + H2O ⇋ CO3 + 2 H3O
例子
碳酸氫鈉
碳酸氫鉀
碳酸氫鈣
碳酸氫銨
特點
碳酸氫根與金屬離子產物的溶解性
碳酸氫根離子不能和氫氧離子大量共存,強調的是“大量”。實際上這兩個離子是可以少量共存的。這牽涉到溶液中的離子平衡問題。任何溶液中都有一個動態的離子平衡,兩種離子的濃度的某次方之積為定值,其中的常數叫做“化學平衡常數”。這就限制了離子的最大濃度,若超過了這個極限,離子濃度就會因反應生成氣體或沉澱等而自動下降回到平衡狀態。
離子檢驗
碳酸根、碳酸氫根離子檢驗的區別與聯繫
碳酸根離子的檢驗在國中就學過:“向溶液中加入足量稀鹽酸,生成氣體,使澄清的石灰水變渾濁,說明溶液中含有碳酸根離子。”乍一看,這個檢驗方式沒有什麼錯誤,也選入了我們的教材,其實只要仔細想想,就會發現其中有諸多不嚴密之處,本文就對其加以分析。
首先,要徹底弄清這個反應,我們必須弄清反應的實質。其實,加入稀鹽酸,是提供了氫離子,氫離子和碳酸根離子結合成不穩定的碳酸,碳酸自動分解出CO2,產生的CO2使澄清石灰水變渾濁。
但是,和澄清石灰水反應的氣體不只CO2一種,常見的還有SO2、HF等,不穩定的酸也有很多,比如H2SO3——問題來了,如果原溶液中有亞硫酸根離子,按照這種檢驗方法,也會出現和碳酸根離子相同的現象(SO3 2-+2H+=H2O+SO2↑,SO2+Ca(OH)2=CaSO3↓+H2O),自然不能說明溶液中有碳酸根離子。
那么,我們必須排除亞硫酸根等離子的干擾,具體的方法我們要對比SO2和CO2的性質。SO2比起CO2有兩條顯著的性質差異:有刺激性氣味和能使酸性高錳酸鉀溶液褪色。於是,排除亞硫酸根等離子的干擾方法出來了——1.加入酸後產生的氣體無色無味。2.該氣體通入酸性高錳酸鉀溶液,酸性高錳酸鉀溶液不褪色。這兩種通常選擇一種即可,為了安全及方便考慮,通常選擇後者,一般先通過足量酸性高錳酸鉀溶液,然後再通入澄清石灰水(避免既有亞硫酸根,又有碳酸根的情況)。
僅此就可以確定溶液中有碳酸根離子了嗎?不是。雖然通過上述反應,確定了生成氣體為CO2,但是與H+反應生成CO2的常見離子有兩種:碳酸根離子、碳酸氫根離子。僅通過上述操作,我們無法確定溶液中的究竟是碳酸根離子,還是碳酸氫根離子,或是二者都有。於是,我們下一步需要確定究竟是哪種情況。
碳酸根和碳酸氫根的一個顯著區別就是碳酸鹽多難溶(鉀鈉等除外),而碳酸氫鹽多可溶或易溶,那么我們需要找一種離子來區分它們。考慮成本及多種因素後,我們通常選擇Ca2+或Ba2+,方法就來了:在以上的基礎上,另取一份加入CaCl2或者BaCl2溶液,以免硫酸根離子等的干擾),若不產生沉澱,那么溶液中只存在碳酸氫根,若產生沉澱,過濾後濾渣中加入稀硝酸,放出CO2氣體(排除硫酸根離子干擾),則為碳酸根或二者混合物,下一步區分只需要過濾後,在濾液中再次加入稀鹽酸,看是否有CO2產生即可。
綜上,檢驗碳酸根離子或碳酸氫根離子的方法如下:首先向溶液中加入足量的稀鹽酸,產生的氣體通過足量的酸性高錳酸鉀溶液後再通入澄清石灰水,澄清石灰水變渾濁。再另取一份溶液,加入CaCl2或BaCl2溶液,如果不產生沉澱,則只含有碳酸氫根離子;如果產生沉澱,且向過濾後的濾渣中加入稀硝酸,沉澱放出CO2,向濾液中加入稀鹽酸,不生成CO2,則只含有碳酸根離子;如果生成CO2,則既含有碳酸根離子,又含有碳酸氫根離子。
毫無疑問方法不只這一種,而且肯定也會有比這種方法更方便的方法,但是這種方法可以在一定程度上準確地判斷出碳酸根、碳酸氫根離子的存在。

