物化性質
| 密度 | 2,32 g/cm3 |
| 熔點 | 115℃ |
| 沸點 | 170℃ |
| 閃點 | 170℃ |
| 溶解性 | 可溶 |
| 化學性質 | 含2.5個結晶水的Cu(NO 3 ) 2 (H 2 O) 2.5 中,中心銅被水分子和硝酸根包圍,為八面體配位。 該水合物在170°C左右分解為氧化銅、二氧化氮和氧氣: 2Cu(NO 3 ) 2 (s) → 2CuO(s) + 4NO 2 (g) + O 2 (g) 可通過熱分解硝酸銅並將產生的氣體導入水中來製取硝酸。該方法與奧斯瓦法最後一步相類似。 2Cu(NO 3 ) 2 → 2CuO + 4NO 2 + O 2 3NO 2 + H 2 O → 2HNO 3 + NO 浸過硝酸銅的薄木條在火焰下發出翡翠綠色的光,加入硝酸鎂則會產生橙綠色。 |
參考資料來源
基本簡介
管制信息:該品不受管制
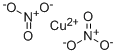 硝酸銅化學分子結構式
硝酸銅化學分子結構式中文名稱:硝酸銅
英文別名:Copper(Ⅱ)nitrate Gerhardite,Cupric nitrate trihydrate,Gerhardite
EINECS號 221-838-5化學式:Cu(NO3)2·3H2O
相對分子質量:241.60
性狀:藍色斜方片狀結晶。有潮解性。170℃分解放出氧。易溶於水和乙醇,幾乎不溶於乙酸乙酯。0.2mol/L水溶液的pH為4.0。相對密度2.05。熔點114.5℃。有氧化性,與炭末、硫黃或其他可燃性物質加熱打擊和摩擦時,發生燃燒爆炸。低毒,半數致死量(大鼠,經口)940mg/kg。
儲存:密封陰涼乾燥保存。
用途
分析鍶。芳香有機矽化合物硝化劑。有機反應 催化劑。
質檢指標值
含量[Cu(NO3)2·3H2O],% 99.0~102.0
pH(50g/L,25℃) 3.0~4.0
硫化氫不沉澱物(以硫酸鹽計),% ≤0.05
水不溶物,% ≤0.002
鐵(Fe),% ≤0.002
氯化物(Cl),% ≤0.001
硫酸鹽(SO4),% ≤0.005
安全術語
S17Keep away from combustible material.
遠離可燃性物質。
S26In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S36/37/39Wear suitable protective clothing, gloves and eye/face protection.
穿戴適當的防護服、手套和護目鏡或面具。
S45In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.)
若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
風險術語
R8Contact with combustible material may cause fire.
與可燃物料接觸可能引起火災。
R22Harmful if swallowed.
吞食有害。
R34 Causes burns.
引起灼傷。
毒學資料
銅鹽使人慢性中毒時,表現為神經系統機能紊亂、肝腎功能障礙、鼻中隔潰瘍形成和穿孔。急性中毒時,引起噁心,嘔吐、腹痛、腹瀉,在血漿和尿中很快出現血紅蛋白、黃疸、貧血,紅細胞抵抗力下降。對皮膚有刺激作用;粉塵對眼睛有刺激,並可引起角膜潰瘍。最高容許濃度以金屬銅計為1mg/m3。
安全措施
貯於陰涼、通風處與還原劑、易(可)燃物、等分儲。皮膚(眼睛)接觸,用流動清水沖洗。吸入,給輸氧或作人工呼吸。
滅火:該品不燃。根據著火原因選擇適當滅火劑滅火。
相關化學品
相關化學品硫酸銅,氯化銅
若非註明,所有數據都依從國際單位制,以及來自標準狀況(25 °C,100 kPa)的條件。
硝酸銅是銅(Ⅱ)的硝酸鹽,化學式為Cu(NO)。無水物和水合物都是藍色晶體,但性質有很大不同。水合硝酸銅常用於在學校中演示原電池反應。
性質
 硝酸銅晶體
硝酸銅晶體水合硝酸銅與無水硝酸銅性質有很大差異。
無水物
亮藍色的無水硝酸銅(Cu(NO))是個易揮發的固體,在真空中升華。氣態時,Cu(NO)單體為平面正方結構,每個Cu原子與四個氧原子相連,冷凝時則發生聚合。
氣態時Cu(NO)單體的大致結構。
水合物
含2.5個結晶水的Cu(NO)(HO)中,中心銅被水分子和硝酸根所包圍,為八面體配位結構。
該水合物在170°C左右分解為氧化銅、二氧化氮和氧氣:
2Cu(NO)(s) → 2CuO(s) + 4NO(g) + O(g)
可通過熱分解硝酸銅並將產生的氣體導入水中來製取硝酸。該方法與奧斯瓦法最後一步類似。
2Cu(NO) → 2CuO + 4NO + O
3NO + HO → 2HNO + NO
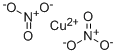 硝酸銅化學分子結構式
硝酸銅化學分子結構式浸過硝酸銅的薄木條在火焰下發出翡翠綠色的光,加入硝酸鎂則會產生橙綠色的光。
合成
含水的Cu(NO)加熱會水解生成鹼式鹽,進一步加熱分解為氧化銅,因此無法通過加熱水合物來製取無水硝酸銅。
無水Cu(NO)可由金屬銅與NO反應製備:
Cu + 2NO → Cu(NO) + 2NO
硝酸銅也可由銅與硝酸銀溶液發生置換反應得到。
Cu+2AgNO=2Ag+Cu(NO)
還可用銅高溫變成氧化銅再用硝酸製取(成本低,無污染)
2Cu+O=高溫=2CuO
CuO+2HNO=Cu(NO)+HO
有關化學反應
Cu+2AgNO==Cu(NO)+2Ag
合成套用
硝酸銅與乙酸酐的混合物(Menke condition)以發現的荷蘭化學家命名,是有機合成中有用的硝化劑,用於芳香化合物的硝化。
硝酸銅承載到黏土(蒙脫土)上後,稱為粘土銅試劑(Claycop),可用於氧化硫醇至二硫化物,轉化縮硫醛為羰基化合物,以及硝化芳香化合物,從而避免大量使用混酸造成的環境污染。
可與氨水作用合成硝酸四氨合銅(TACN,一種含能材料。).

