生物分布
毒魚分布
 河豚毒素
河豚毒素 河魨毒素分布圖冊參考資料。
在河魨體內發現含河魨毒素的器官或組織有肝臟、卵巢、皮膚、腸、肌肉、精巢、血液、膽囊和腎等,其中肝臟含河魨毒素的河魨有34種,卵巢含河魨毒素的有32種,皮膚含河魨毒素的有21種,腸含河魨毒素的有21種,肌肉含河魨毒素的有13種,精巢含河魨毒素的有8種,血液含河魨毒素的有4種,膽囊含河魨毒素的有4種,腎含河魨毒素的有1種。有些種類的河魨,地理分布不同,其體內毒素分布的部位會也有所不同,如台灣海域的紋腹叉鼻魨(Arothron hispidus),其肌肉就有毒性了,而在南海海域,肌肉中則沒有河魨毒素分布;又如東海南部的橫紋東方魨(Takifugu oblongus),僅卵巢、肝臟和腸中含河魨毒素,而在台灣沿海的橫紋東方魨,體內河魨毒素分布較為廣泛,在卵巢、肝臟、腸、膽囊、精巢、肌肉和皮膚中均有分布,不同河魨的河魨毒素分布器官或組織中的河魨毒素量也不同。
程蘇雲等調查了浙江沿海8種河魨的毒性,菊黃東方魨肝和皮膚有很強的毒性,均達到445鼠單位,而黃鰭東方魨各部位的毒性均較低。暗紋東方魨卵巢從III發育到Ⅵ期。卵巢的河魨毒素含量不斷升高,在V期達到最高。然後下降。肝臟的河魨毒素含量也不斷升高,但毒素含量增加不如卵巢明顯,在性腺發育各個時期,眼球、心臟、脾臟、胃腸、皮中的河魨毒素含量沒有顯著提高。用河魨毒素單抗檢測蟲紋東方魨(Takifugu vermicularis)的卵巢,發現河魨毒素累積在卵母細胞的細胞核、卵黃囊和卵黃顆粒中,而在凹鼻魨(Chelonodon patoca)的卵巢,河魨毒素累積在卵巢的結締組織和卵母細胞的細胞核中,在蟲紋東方魨、凹鼻魨和墨斑凹鼻魨(Chelonodon nigroviridis)的皮膚中,發現河魨毒素累積在腺體和粘液細胞中。
其他含毒生物
河魨毒素及類似物不僅存在於各種豚科魚中,還廣泛分布於各種高等、低等生物中,如雲斑裸頰蝦虎魚(Yongeichthys criniger)、織紋螺(Nassarius spp.)等。Asakawa等首次報導牡蠣吊筏上的紐蟲體內含大量的河魨毒素、4-表河魨毒素、脫水河魨毒素及3種未知毒素,最高毒性為14734MU/g。這種紐蟲體質量僅為0.2-1.0 g,就足以殺死13000隻小鼠。紐蟲的毒性變化很大,認為紐蟲可能通過共生的微生物產生河魨毒素或前體。而自1964年Mosher等首次在河魨魚外的動物蠑螈中發現河魨毒素以來,人們對蠑螈體內的河魨毒素及其大量衍生物(1-Hydroxy-5,11-dideoxytetrodotoxin、6-表河魨毒素)的研究興趣越來越濃,主要集中在闡述這種低等動物的代謝途徑。從粗皮漬螈Taricha granulosa體內分離出河魨毒素的10,7內酯型,該成分在河魨毒素合成的第十五步環節中作為前體物質,故研究蠑螈的代謝途徑將有助於更好地解釋河魨毒素的起源。從亞歷山大藻培養液中檢出一定量的河魨毒素,表明亞歷山大藻體內麻痹性毒素和河魨毒素同時存在。Kodama等認為這種麻痹性貝毒的生產者—亞歷山大藻,可能是河魨毒素的來源。即亞歷山大藻也是貝類中河魨毒素毒性的來源,當亞歷山大藻大量繁殖時,貝類體內也積累著高含量的河魨毒素。其他含有河魨毒素的生物有一個共同點,即其體內含有多種能分泌毒素及其類似物的細菌。已從海藻、花紋愛潔蟹(Atergatisfolridus)、多棘槭海星(Astropecten polyacanthus)、圓尾鱟(Carcinoscorpius rotundicauda)、蟲紋東方魨(Fugu vermicularis)和星點東方魨(Takifugu niphobles)、腹足動物(Niotha clethrate)、紐蟲動物中陸續分離到產TTX的細菌,淡水沉積物中也有此類菌、海洋沉積物中分離的鏈黴菌(Streptomycessp.)能產TTX及其衍生物、海膽(Meoma ventricosa)中分離的致病菌VL21也被證實有產毒能力。產TTX的微生物類群有弧菌屬(Vibrio)的溶藻弧菌(Vibrio alginolyticus)和鰻弧菌(Vibrio anguillarum)、假單胞菌屬(Pseudomonas)、希瓦氏菌屬的腐敗希瓦菌(Shewanella putrefaciens)、交替單胞菌(Alteromonas)、芽孢桿菌(Bacillus);放線菌屬的鏈黴菌(Streptomyces)。
物化性質
性質結構
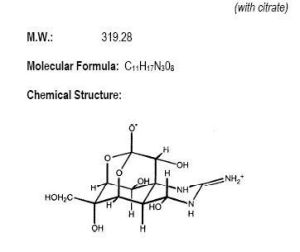
河魨毒素(tetradotoxin,簡寫為TTX)系小分子量非蛋白質神經毒素,中毒潛伏期短,死亡率高,毒素吸收後迅速作用於末梢神經和中樞神經系統,使神經傳導產生障礙,首先感覺神經麻痹,而後運動神經麻痹,嚴重者腦幹麻痹導致呼吸循環衰竭。河魨的表皮、內臟、血液、睪丸、卵巢、肝、脾、眼球等不同組織中含有河魨毒素(tetrodotoxin,TTX),它是一種劇毒的非蛋白神經毒素。其分子式為C11H17O8N3,分子量為319,該神經毒素經腹腔注射對小鼠的LD50為8μg/kg。TTX的化學性質穩定,一般烹調手段難以破壞。河魨毒素是一種重要的天然毒素。1909年日本學者田原純首先從河魨魚中發現,並定名Tetrodotoxino 1950年-1957年間,橫尾晃、津田藤介等人首先從紅鰭東方魨,紫色東方魨卵巢中獨立地分離到了結晶態的河魨毒素。其為無臭、易潮解的白色結晶體。該毒素結構的測定由Woodward(哈佛大學)、平田和後藤(名古屋大學)及津田小組(東京大學一三共中央研究所)等分別完成。1964年在京都召開的國際天然產物化學會議上同時報告了TTX的正確結構,是一種分子量不大,但結構很複雜的籠形原酸酯類生物鹼,分子中幾乎所有的碳原子均有不對稱取代。因此它也被稱為“自然界最奇特的分子之一”。
TTX是一種氨基全氫喹唑啉(Aminoperhydroquinazoline)型化合物,為白色結晶,無臭無味,微溶於水,不溶於有機溶劑;對酸作用穩定,對鹼極不穩定;沒有確定熔點,220℃以上炭化。TTX的結構特徵是有1個碳環,1個胍基,6個羥基,在C-5和C-10位有一個半醛糖內酯連線著的分開的環。在胰液酶、唾液澱粉酶、乳化酶、糖轉化酶等酶類存在下不分解。只溶於酸性水或醇溶液,在鹼水溶液中易分解,在5%氫氧化鉀溶液中於90-100℃下可分解成黃色結晶2-氨基-羥甲基-8-羥基-喹唑啉。它是相當特殊的一種有機化合物,分子內的胍基與氮原子是質子化的,正羰酸也離解為陰離子,所以河魨毒素是以內鹽形式存在。在室溫下用50 g/L的氫氧化鋇處理河魨毒素可得脫水河魨毒素—由pKa1值為2.5的羧基和pKa2值為10.9的胍基組成的兩性離子化合物,其可在水中與一分子的溴完全反應產生河魨酸。河魨毒素在酸中也能部分異構化為脫水錶河魨毒素,從而影響對河魨毒素的提取純度。所以,河魨毒素製劑經過長時間放置可降解。至於河魨酸是否具備毒性尚有爭議。因此,在生物代謝過程中,脫水和脫氧過程會降低毒性,而加氧機制能夠使毒性增強。
在河魨魚中,河魨毒素與其同系物是同時存在的。河魨毒素的同系物種類較多,從河魨、紐蟲、兩棲類等生物體內分離得到的同系物包括:4-epiTTX,6-epiTTX,11-deoxyTTX,11-deoxy-4-epiTTX,11-norTTX-6(R)-ol,11-norTTX-6(S)-ol,11-norTTX-6,6-diol,4,9-anhydroTTX,11-oxoTTX,4,9-anhydro-4-epiTTX,4,9-anhydro-11-deoxyTTX,5-deoxyTTX,tetrodonicacid,4,9-anhydro-6-epi-TTX、5,6,11-trideoxyTTX、4-CysTTX等。這些同系物可能與河魨毒素的代謝或生物合成有關。在河魨毒素的同系物中,5-deoxyTTX、5,6,11-trideoxyTTX、4-CysTTX、4,9-anhydroTTX、4,9-anhydro-6-epi-TTX、河魨酸等同系物的毒性較低,甚至無毒,而11-oxoTTX雖比較罕見,其毒性卻是TTX的4-5倍。它們與河魨毒素性質相似,有一定的生理活性,如:河魨毒素的小鼠LD50為10μg/kg,6-表河魨毒素為60μg/kg,11-去氧河魨毒素為71μg/kg。
提取精製
TTX具有鎮痛、降壓、抗心律失常、局麻、戒毒及抑瘤的功效。對河魨毒素的提取分離研究首先是晶化問題。自從田原於1909年首次分離到TTX的粗素以來,經過了40年,直到橫尾(1950)、津田(1952)、荒川(1956)、平田(1957)等人,才分離出TTX結晶,其分離方法分別為:橫尾法(氧化鋁柱層析),津田—河村法(圓形濾紙層析法),津田—河村大規模生產法(活性炭層析法),平田—後藤法(離子交換樹脂—活性炭吸附法)等。通常TTX的提取步驟是:河魨卵巢—水提取—除蛋白質—離子交換—脫色—活性炭吸附—濃縮—精製—結晶。現代分離河毒素多採用層析法,其具體方法如下:首先,把富含毒素的樣品絞碎,與含1%醋酸的甲醇液一起勻漿以抽提河毒素,勻漿液經5000-6000r/min,離心10-15min,沉澱物再用以上方法重複兩次。合併上清液,減壓濃縮,並用氯仿除去脂肪。之後經過冷凍乾燥或再減壓濃縮,濃縮液經Bio-Gel-P2或CM-Sephadex C-25(NH4+)或Amberlite IRC-50(NH4+)層析,用0.1-0.4 mol/L醋酸洗脫,合併有毒成分,濃縮後再經Bio-Rex70(H+)層析,以0.1-0.3mol/L醋酸洗脫,然後再重複一次,Bio-Rex70(H+)柱層硒,即可得到純度非常高的樣品。日本人田原最早製得的TTX,純度只有0.2%,半數致死量LD50為4.1mg/kg;橫尾用磷鎢酸、苦味酸汞、苯肼、苦味酸汞和苦酮酸等依次處理,得到的粗毒素的LD50為800μg/kg;此後,橫尾又採用氧化鋁柱直接過濾的方法製備,得到的TTX的LD50為13μg/kg。中國於1958年開始進行TTX的提取分離工作。陳成添等採用熱甲醇法、微火煮沸法、沸水浴法對河魨混合卵和混合肝的毒素進行提取,結果顯示,用這三種方法提取的混合卵毒力的均值分別為:熱甲醇法1524,微火煮沸法2518,沸水浴法2491。微火煮沸法和沸水浴法提取效果較佳,熱甲醇法較差。楊春等以含毒量低的棕斑腹刺魨為對象,研究以甲醇、乙醇、乙酸、水等4種溶劑提取TTX,結果發現乙酸的提取效果最好。林文鑾等提出用甲醇乙酸法提取TTX較完全,以活性炭脫色純化的效果最好,但毒力有一定的損失。李世平等以離心法取代傳統過濾法,並用減壓濃縮法去除提取液中的乙醚,改進了乙酸提取法,提高了得率。TTX的分離和提取大多採用離子交換、活性炭柱層析及凝膠柱層析、吸附樹脂等方法。津田一河村用活性炭層析,採用以甲醇提取的浸膏上活性碳柱,以0.8%醋酸-10%甲醇-水洗脫,粗結晶溶於醋酸,加入氨水,低溫下重結晶,1000kg卵巢中可獲得10gTTX。郭慧清等聯合採用吸附樹脂D+D101與弱酸性陽離子交換樹脂D152提取河魨毒素,改進了除蛋白質的方法。中國海洋大學的崔建洲等利用D201大孔樹脂層析、超濾、離子交換層析、分子篩層析、反相製備液相色譜等方法,從假睛東方魨的肝臟中分離純化得到TTX晶體,得率為81.1%。另外,中國國家海洋局第三研究所採用多重膜分離提取技術結合高效液相色譜法製備河魨毒素純品,純度可達99.0%以上。
苦味酸鹽法的氨解也可製備TTX純品,其步驟如下:將粗品毒素(3.2g)和苦味酸(2.3g)溶於29 ml沸水之中,趁熱過濾。冷卻濾液,分離結晶沉澱,此沉澱在熱水中重結晶3次,得黃色針狀結晶的TTX苦味酸鹽(4.8g)。此鹽在200℃以上變黑,但不溶。元素分析樣品需於80-100℃真空乾燥20h。用4.7g苦味酸鹽在熱水中溶解,以氨水調節pH至9,冷卻後,過濾出沉澱固體並加水洗滌。再溶於少量稀醋酸,加入氨水再沉澱,可得到純TTX 2.6g。
根據河魨毒素的微生物起源,分離出產河魨毒素的微生物類群,通過微生物發酵來產生河魨毒素。產TTX 的微生物類群有弧菌屬(Vibrio)的溶藻弧菌(Vibrio alginolyticus)和鰻弧菌(Vibrio anguillarum),假單胞菌屬(Pseudomonas),希瓦氏菌屬的腐敗希瓦菌(Shewanella putrefy aciens),交替單胞菌(Alteromonas),芽孢桿菌屬(Bacillus),鏈黴菌屬(Streptomyces),其中產毒力較高的主要是溶藻弧菌和河魨毒素互生單胞菌(Alteromonas tetrodonis)。但微生物產河魨毒素產量非常低,僅為ng級。其產生機制尚不清楚。
毒理
作用機制
1982年,美國植物學家韋德-戴維斯發現,海地巫毒教中的回魂大師在藥物中使用含有從河魨提取的毒素粉末,整個過程里中毒者大腦能完全保持清醒,如果能挺過24h,他們就會很快恢復正常,且不會出現併發症。使人們相信他們有使人“死而後生”的能力,即所謂的“還魂術”。其實,這是由於河魨毒素的特殊結構使其像塞子一樣,凝固在神經軸突的鈉離子通道的入口處,阻礙鈉離子透過細胞膜傳導神經的衝動,從而關閉神經系統。由於河魨毒素不能越過大腦中血液細胞的屏障,因此受害者就會處於大腦清醒的無助狀態之中。幾小時或幾天過後,當河魨毒素最終開放鈉離子通道時大多數受害者已經死亡。TTX是典型的鈉離子通道阻斷劑,它能選擇性與肌肉、神經細胞的細胞膜表面的鈉離子通道受體結合,阻斷電壓依賴性鈉離子通道,從而阻滯動物電位,抑制神經肌肉間興奮的傳導,導致與之相關的生理機能的障礙,主要造成肌肉和神經的麻痹。構效關係表明,TTX的活性基團是1,2,3 位的胍氨基和附近的C-4,C-9,C-10 位的羥基,胍基在生理pH值下發生質子化,形成正電活性區域與鈉離子通道受體蛋白的負電性羰基相互作用,從而阻礙離子進入通道。鈉離子受體至少有6個特異性靶分子結合位點,TTX是與鈉通道受體部位I結合。TTX受體位於可興奮細胞膜外側、鈉通道外口附近,TTX與受體部位結合,阻礙鈉離子接近通道外口。研究表明,TTX特異性作用於鈉通道,對鉀、鈣通道和神經肌肉的突觸及膽鹼指酶無直接影響。此外,毒素能通過血腦屏障進入中樞,對中樞產生明顯的抑制作用。總的來說,TTX對呼吸和心血管的抑制是對中樞和外周的共同作用結果。
河魨毒素毒理作用的主要表征是阻遏神經和肌肉的傳導。除直接作用於胃腸道引起局部刺激症狀外,河魨毒素被機體吸收進入血液後,能迅速使神經末梢和神經中樞發生麻痹,繼而使得各隨意肌的運動神經麻痹;毒量增大時會毒及迷走神經,影響呼吸,造成脈搏遲緩;嚴重時體溫和血壓下降,最後導致血管運動神經和呼吸神經中樞麻痹而迅速死亡。TTX可選擇性地抑制可興奮膜的電壓,阻礙Na+通道的開放,從而阻止神經衝動的發生和傳導,使神經肌肉喪失興奮性。此後,多數研究工作都是圍繞著TTX阻斷可興奮組織的Na+通道而展開。河魨對TTX具有抵抗力和免疫性。如果該區域出現由芳香性胺基酸向非芳香性胺基酸的胺基酸置換,就會顯著影響它與TTX結合的靈敏度。在對河魨毒素沒有免疫力的生物體內,鈉通道的α-亞基上存在河魨毒素的受體,河魨毒素與α-亞基門孔附近的胺基酸殘基結合,阻止鈉離子進入細胞內,引起河魨毒素中毒。而河魨體內細胞的構造與其他生物不同,河魨體內還存在可以與河魨毒素結合的其他蛋白質,從而使河魨對體內的河魨毒素具有免疫力。比較紅鰭東方魨(Fugu rubripes)、黑青斑東方魨(Tetraodon nigroviridis)和斑馬魚的基因序列圖譜,發現紅鰭東方魨和黑青斑東方魨骨骼肌的Nav1.4通道發生了變異,正是這種變異使河魨具有抵抗河魨毒素的能力。紅鰭東方魨和豹紋東方魨的變異類似,都是在Nav1.4通道的401位點上發生了取代,取代為一個摺疊程度更高的不飽和胺基酸。河魨的這些胺基酸是不與河魨毒素結合的,從而也就不能對河魨的鈉通道造成影響。通過克隆調控豹紋東方魨骨骼肌Nav1.4通道表達的cDNA,發現Nav1.4通道區域Ⅰ401位點處存在一個不飽和胺基酸,即天冬醯胺。通過基因工程把不飽和胺基酸移植到對河魨毒素敏感的小鼠骨骼肌Nav1.4通道處,移植的不飽和胺基酸的摺疊程度越高,小鼠抵抗河魨毒素的能力越強。當不飽和胺基酸的摺疊程度大於取代位點胺基酸摺疊程度的2500倍時,IC50(50%Na+通道發生阻斷時河魨毒素的濃度)提高至47μmol/L。
一些生物對河魨毒素的耐受性與其獨特的鈉離子通道結構有關。研究發現,3×10^-6M的河魨毒素對Arothron hispidus等7種河魨魚肌肉的動作電位沒有影響,而3×10^-7M的河魨毒素卻阻斷了3種不含河魨毒素的其他魚的動作電位。河魨毒素的結合位點位於鈉離子通道內高度保守的成孔區域(P-loop),對河魨毒素敏感的鈉離子通道(TTX-sensitiveNa+channel)在該區域有與TTX高度親和的芳香性胺基酸。如果該區出現由芳香性胺基酸向非芳香性胺基酸的胺基酸置換,就會顯著影響其與TTX結合的靈敏度,從而使鈉離子通道成為抗河魨毒素的鈉離子通道(TTX-resistantNa+channel)。通過對河魨魚(Fugu pardalis)骨骼肌Nav1.4通道的cDNA基因序列圖譜的研究發現,通道的結構域I的成孔區域的401位置包含有一個非芳香胺基酸,即天冬醯胺酸,而此位點發生的胺基酸置換可能與河魨魚對高濃度的TTX耐受有關。在捕食與防禦的長期進化過程中,在北美西部,一些束帶蛇對河魨毒素也具備了一定的耐受力,而且,不同地區的束帶蛇對河魨毒素的耐受力也有明顯差異。對這些束帶蛇的Nav1.4通道進行分析發現,他們的芳香胺基酸在401位點是保守的,但在結構域IV的成孔區域發生了幾處胺基酸置換。在WillowCreek地區的束帶蛇的Nav1.4通道的結構域IV包含有3個胺基酸的置換,該地區束帶蛇對TTX的耐受力比Benton地區的高兩個數量級,因為後者只包含1個胺基酸替代。只在河魨魚與束帶蛇中發現它們對河魨毒素的耐受性與其骨骼肌和神經元的鈉離子通道發生了胺基酸替代有關。這兩種生物之間的一個主要差別就是,幾乎所有的河魨魚對TTX都有一定的耐受性,而且有相同耐受機制,但是只有一部分束帶蛇具有對TTX的耐受力。
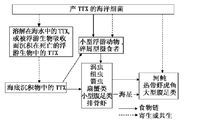
毒素起源
起源內因說主張內因說的學者認為,河魨等生物體含有的刺胞、毒腺中的蛋白質毒素是內源性毒素的來源。他們推測河魨魚體內有特定功能或微生物,能將攝入的食物轉化為毒素。但始終沒有更多證據證實這種說法,因此內因說沒有得到廣泛認可。不少研究者認為,許多海洋細菌能產生河魨毒素,作為河魨魚類食物的一些動物,如海星等也含有河魨毒素,而人工飼養的河魨卻沒有河魨毒素,表明河魨本身並無產生TTX的能力。但後來河魨毒素由細菌產生的觀點遭到了反駁,Kmatsumura在1995年就發現從解藻朊酸弧菌(Vibrio alginolyiicus)中提取出來的河魨毒素並沒有與河魨毒素的單克隆抗體發生反應,認為生物鑑定法存在弊端,因此有必要重新認識“TTX是由細菌產生的”這一觀點。為了證實產生河魨毒素的原因是內源性的,Kendo於1998年提取了星點東方魨成熟的卵細胞進行人工授精及胚胎培育,發現在孵化過程中胚胎體內河魨毒素的含量一直在增加。這表明增加的毒素是胚胎的產物。由此可知,河魨體內的TTX可能並非直接來源於細菌,而是河魨本身與其體內共生細菌共同的產物。河魨等動物自身是否具有分泌毒素的功能,以及河魨毒素如何在機體各器官內發生轉移等,還有待進一步研究。
而且,河魨毒素在河魨之外的物種分布,和河魨體內細菌能分泌河魨毒素等現象,不能說明河魨本身不能產生河魨毒素。Matsumura就對河魨毒素的細菌起源提出了質疑,他發現弧菌(Vibrioalginolyticus)所產的河魨毒素並不能和河魨毒素的單克隆抗體反應,說明細菌產生的河魨毒素與河魨體內的河魨毒素並不完全相同。但細菌產生的河魨毒素同樣能使小鼠致死,說明其可能是河魨毒素的衍生物。但是,內源假說同樣不能解釋一些事實,僅在投餵配合飼料的條件下,人工養殖的河魨體內的河魨毒素沒有或含量很低,此事實很難用內源假說來解釋。Matsui等認為河魨體內有一種能夠儲藏TTX的機制。但是,如果河魨僅僅能儲藏河魨毒素,同樣也難以解釋胚胎髮育過程中河魨毒素含量一直在增加的現象。因此,河魨體內的河魨毒素極有可能是河魨與其體內共生細菌共同的產物,體內共生細菌產生河魨毒素的衍生物,河魨把此衍生物轉化為河魨自身的河魨毒素。河魨胚胎髮育過程中河魨毒素含量一直在增加,可能是共生細菌產生的河魨毒素衍生物,在卵子受精前就已經累積在卵中,受精後的胚胎髮育過程中,河魨胚胎逐漸具備把此衍生物轉化為自身河魨毒素的能力。因此,胚胎髮育過程中河魨毒素含量可持續增加。
外因說
在Mosher等從加州蠑螈(Tarichatorosa)中分離到河魨毒素以前,河魨毒素一直被認為是河魨產生的,之後,在蝦虎魚、蛙類、馬蹄蟹、海星、紐蟲、箭蟲、環節動物、石灰質藻類等中均分離到河魨毒素,使人們相信河魨毒素的分布比較廣泛。1986年,Noguchi等首次報導了從花紋愛潔蟹(Atergatisfloridus)的腸道內分離到一種產河魨毒素的細菌,1987年,Noguchi等從蟲紋東方魨腸道中也分離出能產河魨毒素的細菌Vibrio alginolyticus,此後,從各種動物的多種動物體內或體表、海洋沉積物、淡水沉積物中也分離到了產河魨毒素及其衍生物的各種微生物,這些發現,使人們更加相信河魨體內河魨毒素的體外起源假說,日本的清水、松居是最早提出“外因說”的學者。他們用含TTX的餌料飼餵人工養殖的無毒河魨及人工采苗後飼養的河魨,結果這些無毒河魨發生毒化現象。由此推測,毒素的起源可能是外因性的。該假說認為河魨體內河魨毒素來源於環境中的河魨毒素或產河魨毒素的細菌。
Noguchi等採用小鼠和液相-質譜技術調查了日本1990到2003期間在離開海底10米以上的網箱養殖紅鰭東方魨的河魨毒素毒性情況,在肝臟、皮膚、肌肉、性腺中均沒有檢測到河魨毒素(檢測靈敏度>>回到科學頻道