多相反應過程
正文
傳遞特徵 與單相反應過程相比,多相反應過程的傳遞特徵是:考察反應器內的任一尺度遠小於反應器,但遠大於分子的微元,微元中濃度和溫度通常是不均勻的,存在相際傳質和傳熱。在反應器的不同微元間也可存在濃度和溫度的差異,從而導致設備尺度上的傳質和傳熱。對於流體相(氣相或液相)本身,也存在微觀均勻問題。多相反應過程的物系雖有多相,但反應則常在一相中進行(在多相中同時進行反應的情形比較罕見),通常稱發生反應的相為反應相,而稱其他相為非反應相。為使反應得以進行,必須先使反應物向反應相傳遞,例如氣固相催化反應中,氣相反應物必須經反應相外部和內部傳遞(見反應相外傳質和傳熱及反應相內傳質和傳熱)到達固體催化劑的活性表面才能發生反應。反應相外部傳質和內部傳質的一個重要差別是前者為單純的傳質過程,後者屬於反應與傳質同時進行的過程。多相反應過程中熱量傳遞的方向因反應為放熱或吸熱,以及反應過程中有無物料相變(氣化或冷凝)而異。
處理方法 多相反應過程系由外部傳質、內部傳質和化學反應所組成的過程,後兩者相併聯又與前者相串聯。通常反應相內外都存在濃度分布(見圖)和溫度分布,相內不同部位的反應速率(見反應動力學)和選擇性(見化學計量學)各不相同,表觀反應速率和選擇性是相內各處反應速率和選擇性的某種均值。如果相串聯的各步驟中某一步驟的阻力,遠大於其他步驟而成為整個過程的控制步驟,定態下過程的總速率實際上取決於該步驟的速率,處理可大為簡化。
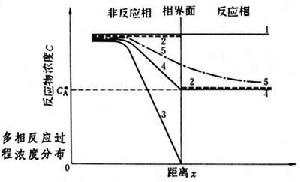 多相反應過程
多相反應過程當反應相外傳質為速率控制步驟時,反應相內反應物濃度趨於零(線3)或化學平衡濃度(線4),單位時間內反應物轉化量與相界面積成正比,而與反應相體積幾乎無關,過程速率的計算與傳質過程類似。若過程不存在速率控制步驟,則反應相內外均存在濃度梯度,其濃度分布(線5)介於上述兩種極端情況之間。
