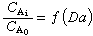反應相外傳質和傳熱
正文
簡稱外部傳遞過程。多相反應過程中反應器傳遞過程之一,反應相外部(以下簡稱外部)進行的即非反應相與相界面之間的傳質和傳熱。反應相內傳質和傳熱為反應器中的另一傳遞過程。多相反應的進行,首先必須依靠反應物由非反應相傳向相界面,然後再由相界面傳向反應相,反應產物則從反應相傳向相界面,然後再由相界面向外部傳遞。例如氣固相催化反應中,反應物向催化劑外表面傳遞,產物則從催化劑外表面向氣相主體傳遞。由於反應的熱效應,也伴隨著相應的熱量傳遞。由於外部的傳質阻力,所以在相界面處,反應物A的濃度必然低於外部主體,產物的濃度則高於外部主體濃度。因為界面上反應物的濃度難以直接測定,故常以外部主體濃度作為基準,並採用外部效率因子的概念來描述相外傳質對反應速率的影響。
外部傳質模型 設以C岹表示反應物外部主體濃度,C岟為反應物界面濃度。對各級反應來說,雖函式形式不同,但均有:
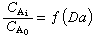
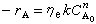
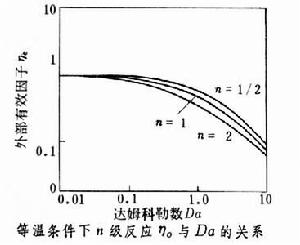 可作如下分析:①如果Dɑ值接近於0,則ηe接近於1,過程為反應控制,表觀速率不受傳質影響。這時表觀動力學與本徵動力學接近。②如果Dɑ值很大,則ηe很小,過程為傳質控制,表觀速率取決於傳質速率,表觀動力學與擴散動力學相近。表觀級數趨向於1級,表觀活化能由於傳質係數的溫度效應很小而趨於零。③Dɑ值高表示傳質阻力大,界面反應物濃度低,對於高反應物濃度和低產物濃度有利的反應(如伴有串聯副反應的反應),Dɑ值高總是不利因素。對於平行反應,只有當主反應級數低於副反應級數時Dɑ值高才為有利。
可作如下分析:①如果Dɑ值接近於0,則ηe接近於1,過程為反應控制,表觀速率不受傳質影響。這時表觀動力學與本徵動力學接近。②如果Dɑ值很大,則ηe很小,過程為傳質控制,表觀速率取決於傳質速率,表觀動力學與擴散動力學相近。表觀級數趨向於1級,表觀活化能由於傳質係數的溫度效應很小而趨於零。③Dɑ值高表示傳質阻力大,界面反應物濃度低,對於高反應物濃度和低產物濃度有利的反應(如伴有串聯副反應的反應),Dɑ值高總是不利因素。對於平行反應,只有當主反應級數低於副反應級數時Dɑ值高才為有利。 在等溫條件下,對於正級數反應,ηe恆小於1。當界面溫度高於非反應相主體溫度時,界面溫度下的反應速率常數大於非反應相主體溫度下的反應速率常數,ηe可大於1,需根據溫升另行計算。
外部傳熱 與傳質有類似的關係。在反應相為分散相的情形下,反應熱主要通過相際傳熱移去或輸入。相界面溫度Ti與連續相主體溫度T之差為: