克拉珀龍方程
PV=nRT
正文
兩相平衡時,表達相變溫度與蒸氣壓間關係的方程。某物質處於兩相平衡時,若蒸氣壓為p,熱力學溫度為T,第一相和第二相的比容(即體積度)分別為v1和v2,單位質量的物質由第一相經準靜態過程轉變為第二相的相變潛熱為l12,則克拉珀龍方程為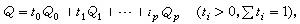
阿佛加德羅定律推論
一、阿佛加德羅定律推論
我們可以利用阿佛加德羅定律以及物質的量與分子數目、摩爾質量之間的關係得到以下有用的推論:
(1)同溫同壓時:①V1:V2=n1:n2=N1:N2 ②ρ1:ρ2=M1:M2 ③ 同質量時:V1:V2=M2:M1
(2)同溫同體積時:④ p1:p2=n1:n2=N1:N2 ⑤ 同質量時: p1:p2=M2:M1
(3)同溫同壓同體積時: ⑥ ρ1:ρ2=M1:M2=m1:m2
具體的推導過程請大家自己推導一下,以幫助記憶。推理過程簡述如下:
(1)、同溫同壓下,體積相同的氣體就含有相同數目的分子,因此可知:在同溫同壓下,氣體體積與分子數目成正比,也就是與它們的物質的量成正比,即對任意氣體都有V=kn;因此有V1:V2=n1:n2=N1:N2,再根據n=m/M就有式②;若這時氣體質量再相同就有式③了。
(2)、從阿佛加德羅定律可知:溫度、體積、氣體分子數目都相同時,壓強也相同,亦即同溫同體積下氣體壓強與分子數目成正比。其餘推導同(1)。
(3)、同溫同壓同體積下,氣體的物質的量必同,根據n=m/M和ρ=m/V就有式⑥。當然這些結論不僅僅只適用於兩種氣體,還適用於多種氣體。
二、相對密度
在同溫同壓下,像在上面結論式②和式⑥中出現的密度比值稱為氣體的相對密度D=ρ1:ρ2=M1:M2。
注意:①.D稱為氣體1相對於氣體2的相對密度,沒有單位。如氧氣對氫氣的密度為16。
②.若同時體積也相同,則還等於質量之比,即D=m1:m2。
