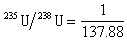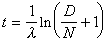概述
兩種單體M1和M2以等分子進入共聚物, 並沿著高分子鏈呈交替排列的共聚合。這類共聚的特徵是競聚率r1=r2=0,這樣,共聚合方程就可簡化為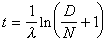 。因此不管原料單體的組成如何,在共聚物組成中M1單體所占的分子分數F1總是等於0.5,共聚物中兩種單體單元嚴格地呈交替排列。交替共聚的實例見表1。
。因此不管原料單體的組成如何,在共聚物組成中M1單體所占的分子分數F1總是等於0.5,共聚物中兩種單體單元嚴格地呈交替排列。交替共聚的實例見表1。 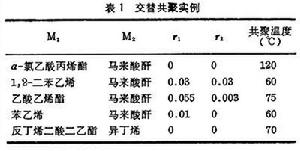 交替共聚
交替共聚在進行交替共聚的單體中,有的均聚傾向很小或根本不均聚。例如具有吸電子基團的馬來酸酐(順丁烯二酸酐)就不均聚;但它能與具有給電子基團的單體(如苯乙烯或乙烯基醚等)進行交替共聚。又如馬來酸酐與具有給電子取代基的1,2-二苯乙烯都不能明顯地均聚;但它們卻能交替共聚。所以交替效應實質上反映了單體之間的極性效應。例如苯乙烯和馬來酸酐的交替共聚,是由於有給電子取代基的苯乙烯與有吸電子取代基的馬來酸酐之間發生電荷轉移而生成電荷轉移絡合物的結果:
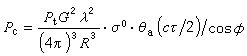
取代基吸電子能力不夠強的單體(如丙烯腈或甲基丙烯酸甲酯)與苯乙烯之間只能進行無規共聚;但是如果加入氯化鋅,則它能與丙烯腈或甲基丙烯酸甲酯絡合,使這兩種單體的取代基的吸電子能力增強,它們都可以與苯乙烯形成 1:1的電荷轉移絡合物,並得到交替共聚物。
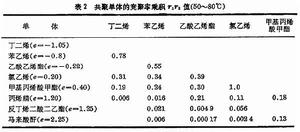
還有不少共聚體系的r1和r2都遠小於1,r1r2之積也就很小,這些共聚體系也有較明顯的交替共聚傾向。
表2中的單體是根據它們的極性因子 e值(見競聚率)由小到大排列的,從表中的r1r2之積的值來看,一般是極性差別越大的單體,它們交替共聚的傾向也越大,但有時空間因素在決定交替共聚的傾向時也起作用。
 交替共聚
交替共聚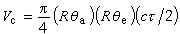
但是這類交替共聚反應大多數不能生成分子量很大的聚合物,這可能是由於正、負電荷的距離越來越遠的緣故。
通過單體與催化劑的交替絡合也可導致交替共聚,例如在VO(acac)2-Al(C2H5)2/TiCl4(acac代表乙醯丙酮基)的催化下,烯烴和雙烯烴單體依次交替地與催化劑中的二價釩絡合。當末端是烯烴單體(如丙烯)時,二價釩可以與雙烯烴單體(如1,3-丁二烯)形成雙齒形絡合物(a);當末端是雙烯烴時,形成的π-烯丙基末端與二價釩絡合,使二價釩無法再與雙烯烴單體絡合成雙齒形絡合物,但可以與單烯烴絡合形成單齒形絡合物(b),因此在這種情況下丙烯和丁二烯可以聚合形成交替共聚物。