目錄
• 1基本信息:
• 2學習者特徵分析:
• 3學習內容分析:
• 4教學目標分析
• 5教學重點與難點
• 6教學策略的選擇與設計
【說明】:此教學設計任務由南京曉莊學院現代教育技術課程老師yqiong參與教師-維基星光計畫進行wiki教學而發布。此詞條為範例詞條,由翟瑩瑩選定主題並負責、參與現代教育技術課程的所有同學協作共同完成!
基本信息
科目:有機化學教學對象:高中一年級
課時:10 教學環境:多媒體教室
學習者的特徵分析
在前幾章的學習中,學生已經學會利用化學方法解決化學問題,但元素化學的內容龐雜、瑣碎,學起來枯燥乏味,記憶困難,學生不感興趣。熱愛是最好的老師。因此,如何激發學生學習元素化學的興趣,充分發揮其主觀能動性,成為“無機化學”教學中的重要課題。
學習本章內容,要掌握好前面所學的基礎知識,比如,物質的量,化學反應速率等等章節的內容。學生綜合運用前面所學的知識的能力還不強,通過學習本章,可進一步提高解決化學問題的能力。
學習內容的分析
各類金屬
本節課的教學內容是廣東教育出社版、高中課程標準實驗教材必修模組一《化學1》中的第4章
包括:常見金屬元素(如鹼金屬、鋁、鎂、鐵和銅等)
1.常見金屬元素單質及其重要化合物的主要性質,了解其套用。
2.常見金屬元素單質及其重要化合物對環境質量的影響。
3.鈉及其化合物鈣及其化合物 鎂及其他合物 鋁及其合物 鐵及其化合物
本章內容可以為前面所學的實驗和理論補充感性認識的材料;又可以為學生今後學習物質結構、元素周期律、化學反應與能量等理論知識打下重要的基礎,積累豐富的感性材料;還可以幫助學生逐步掌握學習化學的一些基本方法。學生要具備從原子分子層次理性的認識物質及其變化的能力,要認識化學科學對促進社會可持續發展的價值,沒有元素化合物知識的感性認識,是不可能的。不僅如此,元素化合物組成、結構、性質、變化與製備的知識也是聯考考查學生的化學科學素養和化學學習能力相關試題的重要載體。
教學目標分析
一.掌握常見金屬元素單質及其重要化合物的主要性質,了解其套用。
二。了解常見金屬元素單質及其重要化合物對環境質量的影響。
三.以上各部分知識的綜合套用 知識網路
1.鈉,鈣及其化合物
2.鎂及其他合物
3.鋁及其合物
4.鐵及其化合物
四。以典型的金屬—ⅠA和ⅡA族元素中的鈉、鎂為例,從其原子的核外電子排布入手,理解ⅠA和ⅡA族(單質、化合物)的相似性和遞變性。了解典型金屬(鈉、鎂、鋁、鐵和銅)的物理性質和化學性質。綜合運用一些重要化合物的性質進行解題
重點掌握Na2O、Na2O2;鋁、氧化鋁、氫氧化鋁的兩性、Al3+、AlO2-、Al(OH)3和Fe、Fe2+、Fe3+的三角相互轉變
教學重點與難點
難點
Na2O、Na2O2的性質;鋁、氧化鋁、氫氧化鋁的兩性、Al3+、AlO2-、Al(OH)3和Fe、Fe2+、Fe3+的三角相互轉變
重點
1.鈉,鐵,鎂,鋁元素及其化合物
在中學化學課本中,元素及其化合物的章節,都有一個具有代表性的元素(如鹼金屬中的鈉元素)。從這些代表性的元素及其化合物的性質能類推該族其他元素及化合物的性質的性質,這也是元素及其化合物章節由一般到特殊的一個編排體系,同時也是我們認識事物的一個重要方法—演繹(由一般到特殊)。因此,在學習過程中抓住典型、代表性的元素及其化合物重點學習就顯得尤為重要,而且這部分知識也是各類考試中頻繁出現的內容。
2.注重金屬族內和族間元素及其化合物的對比、歸納
在歸納和對比中發現同族元素及其化合物在各方面(如結構、性質等)的相同點和遞變性,發現相鄰族元素及其化合物各方面(如結構、性質等)的相似性。在知識的對比、歸納中加深印象、深化理解。在學習鹼金屬時,可將金屬鋰到金屬銫分別與水、氧氣、鹵素單質反應時發生的現象、生成的產物等多方面列表進行對比,歸納總結鹼金屬元素化學性質的共同點和遞變性。
3.化學實驗
對於課堂演示實驗,要善於去觀察實驗現象,嘗試用規範的化學用語描述實驗現象、解釋現象發生的原因;對於學生實驗要勇於去參與,培養自己的實驗操作能力。特別是對於一些探索性的開放型的實驗,是對實驗能力與理論知識的綜合考查。在學習過程中體會化學實驗對化學理論知識的鞏固加深,化學理論知識是對化學實驗的指導。
4.了解常見金屬的活動順序。
5.了解常見金屬及其重要化合物的主要性質,了解其套用。以鈉為例,了解鹼金屬的物理性質和化學性質。理解鹼金屬元素性質的相似性和遞變性。 以氫氧化鈉為例,了解重要的鹼的性質和用途。了解鈉的重要化合物(如碳酸鈉和碳酸氫鈉)。 以Na2O2為例,了解過氧化物的性質。
6.了解焰色反應,並能用焰色反應檢驗鈉、鉀等元素。鹼金屬元素是近幾年聯考的重點內容之一,涉及的內容有:鈉、鉀與水、鹽溶液反應的現象及產物;Na2O2與CO2、H2O發生的反應;NaOH作為強鹼,與很多物質發生複分解反應,此內容廣泛出現在離子方程式、物質的鑑別、提純和離子共存中; Na2CO3、NaHCO3性質的異同,以及互相轉化、提純,還有由它們組成的混合物的計算;同族元素性質的判斷,其中尤以涉及Na2O2的題目更為常見。
教學策略與設計
1.結合真實問題創設情境,實現知識探究和知識意義的構建我們可以利用日常生活中很多具有現實意義的情景,讓學生參與進來,在真實的問題情境中,學生為了解決問題,會自覺地調動各種思考方法,用頭腦風暴法、對比歸納法從生活和經驗中提升處知識,尋找問題的答案,同時看到了身邊的化學,體驗了探索的苦和發現的樂。進而實現了知識的探究和知識意義的構建。
2.充分利用感性知識、素材,整合資源,培養學生“問題意識”,搭建研究性學習橋樑
元素化合物的教學中,要運用現代技術、實驗現象、模型、圖表、文字描述為學生提供物質組成、結構與性質變化的信息,要幫助學生從中獲取有用的信息,聯繫、運用存貯的知識,通過分析、綜合和必要的推理、論證,獲得新知。從某種角度看,元素化合物的教學重點,不在於詳盡系統地掌握元素化合物知識,而在於能否幫助學生通過對實驗現象、實物、模型、圖形、圖表以及自然界、生產和生活中的化學現象的觀察,獲取有關的感性知識和印象,提高對這些感性知識進行初步加工和記憶的能力。
3.通過元素化合物知識的分類、比較、歸納常見無機物的重要性質,提高比較、觀察、分析問題能力,同時著重培養學生自我設計實驗的能力;在元素化合物教學中,要儘量聯繫已學概念原理知識,分析說明元素化合物的組成、結構或變化知識,驗證物質組成、結構和變化的客觀規律。
4注意對學生實驗的整體規劃和進行有計畫的指導,進行實驗前指導、實驗中指導和實驗後指導。
總之,儘管元素化合物知識內容在覆蓋面上與現行課程的差別不大,但在內容的組織線索、具體化合物知識內容的選取以及處理的深廣度、學習的重點和方式等都有了較大的變化。《新課標》沒有明確給出和限定要學習這些元素的那些具體化合物,這與傳統教材相比,弱化了按照族來介紹元素化合物知識的做法。新課程元素化合物教學真正體現了內容向少而精變化,提倡“從生活走進化學,從自然走進化學,從化學走向社會”,是化學科學發展對中學化學教學內容選擇影響的反映。
教學過程與媒體資源
(一)金屬元素概述
 2
2 4
4 3
31、金屬在元素周期表中的位置及結構特點:金屬元素分布在周期表的左下部,金屬元素原子最外層電子數比同周期非金屬元素原子最外層電子數少,一般小於4(Ge、Sn、Pb=4,Sb、Bi=5,Po=6)。金屬元素原子半徑比同周期非金屬原子半徑大。金屬原子的結構特點決定了金屬原子易失去電子顯強還原性。金屬元素形成的金屬單質固態時全是金屬晶體。
2、金屬的物理性質:
通性:
(1)狀態:通常情況下,除汞外其他金屬都是固態。
(2)金屬光澤:多數金屬具有光澤,但除Mg、Al、Cu、Au在粉末狀態有光澤外,其他金屬在塊狀時才表現出來。
(3)易導電、導熱:由於金屬晶體中自由電子的運動,使金屬易導電、導熱。
(4)延展性。
(5)熔點及硬度:由金屬晶體中金屬離子跟自由電子間的作用強弱決定。
特性
(1)顏色:絕大多數金屬都是銀白色,有少數金屬具有顏色,例如:Au為金黃色,Cu為紫紅色,Cs為銀白略帶金色。
(2)密度:與原子半徑、相對原子質量、晶體質點排列的緊密程度有關。最重的金屬為鋨(Os22.57g·cm (3)、鉑(Pt21.45g·cm-3),最輕的金屬是鋰(Li0.534g·cm-3)
(3)熔點:最高的金屬是鎢(W3413℃),最低的為汞(Hg-39℃)。
(4)硬度:最硬的金屬為鉻,最軟的金屬為鉀(K)、鈉(Na)、銫(Cs)等,可用小刀切割。
(5)導電性:導電性較強的金屬是銀(Ag)、金(Au)、銅(Cu)等。導電性較差的金屬為汞(Hg)。
(6)延展性:延展性最好的金屬是金(Au)。
3、金屬單質的化學性質
金屬活動順序
KCaNa
MgAlZn
FeSnPb
(H)
CuHgAg
PtAu
原子失電子能力
由大到小,還原性由強到弱
陽離子得e-能力
由小到大,氧化性由弱到強
和O2反應
常溫被氧化
常溫能被氧化(生成氧化膜)
常溫乾燥空氣中不易被氧化
加熱時能被氧化
不能被氧化
和H2O反應
常溫置換出氫
加熱或與H2O(g)反應置換出氫
不能置換水中的氫
和酸反應
劇烈置換出酸中的氫
能置換出酸中的氫,Fe、Al常溫在濃HNO3、濃H2SO4中“鈍化”
不能置換稀酸中的氫
與氧化性酸反應
只與王水反應
和鹼反應
僅Al和Zn能跟強鹼水溶液反應生成H2
和鹽反應
先與水反應
前面的金屬從鹽溶液中置換後邊的金屬
鹼的熱分解
受熱不分解
受熱分解
常溫分解
硫化物溶解性
溶於水
水解
不溶於水,溶於非氧化性稀酸
只溶於強氧化性酸
冶煉方法
電解法
熱還原法
加熱分解法
物理方法
4、金屬的冶煉方法
金屬活動順序
KCaNa
MgAlZn
FeSnPb
(H)
CuHgAg
PtAu
原子失電子能力
由大到小,還原性由強到弱
陽離子得e-能力
由小到大,氧化性由弱到強
和O2反應
常溫被氧化
常溫能被氧化(生成氧化膜)
常溫乾燥空氣中不易被氧化
加熱時能被氧化
不能被氧化
和H2O反應
常溫置換出氫
加熱或與H2O(g)反應置換出氫
不能置換水中的氫
和酸反應
劇烈置換出酸中的氫
能置換出酸中的氫,Fe、Al常溫在濃HNO3、濃H2SO4中“鈍化”
不能置換稀酸中的氫
與氧化性酸反應
只與王水反應
和鹼反應
僅Al和Zn能跟強鹼水溶液反應生成H2
和鹽反應
先與水反應
前面的金屬從鹽溶液中置換後邊的金屬
鹼的熱分解
受熱不分解
受熱分解
常溫分解
硫化物溶解性
溶於水
水解
不溶於水,溶於非氧化性稀酸
只溶於強氧化性酸
冶煉方法
電解法
熱還原法
加熱分解法
物理方法
4、金屬的冶煉方法
(1)電解法:活潑金屬(K~Al)的冶煉常採用電解它的熔鹽或氧化物的方法。
(2)還原法(高溫)
金屬活動性順序表中Zn~Cu之間的金屬常採用此法冶煉。常用的還原劑有:H2(CuO→Cu)、C(ZnO→Zn)、Na(TiCl4→Ti)、Al(Cr2O3→Cr)、CO(Fe2O3→Fe)等。
(3)加熱法
用於冶煉不活潑金屬Hg、Ag。加熱使HgO、HgS、Ag2S分解。
(4)濕法:Fe+CuSO4=FeSO4+Cu
(5)物理法:Au、Pt在自然界中主要以游離態存在。
5.鈉及其化合物(學生填表格)
(二)金屬元素及其化合物之間的相互轉化關係:
1、鈉及其化合物的相互轉化:
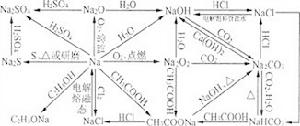 Na
Na2、鎂及其化合物之間的相互轉化:
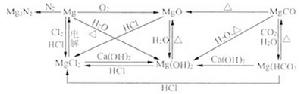 Mg
Mg3、鋁及其化合物之間的相互轉化
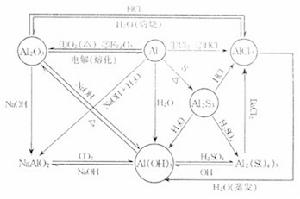 Al
Al4、鐵及其化合物之間的相互轉化:
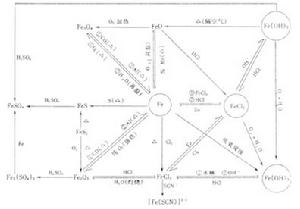 Fe
Fe說明:
1、金屬的通性:掌握金屬的活動性順序與掌握金屬的化學性質,金屬的化學性質主要表現為易失去最外層的電子,顯示還原性,這與它們的原子結構有關。
金屬活動性順序就是金屬單質的還原性由強漸弱的順序。按金屬活動性順序,把常見金屬分為以下三組:
活潑金屬組:K、Ca、Na,Mg、Al;
中活潑金屬組:Zn、Fe,Sn、Pb、(H);
不活潑金屬組:Cu、Hg、Ag,Pt、Au。
如上所示,每個金屬組又分為兩個不同層次,顯示其還原性的差異。這樣複習金屬單質的化學性質,有利於掌握金屬的全局,以及金屬還原性強弱的變化規律。
(1)跟O2反應:K、Ca、Na、Mg、Al迅速氧化,Zn、Fe、Sn、Pb緩慢氧化,Cu、Hg、Ag、Pt、Au很難氧化。
(2)跟H2O反應:K、Ca、Na跟水反應劇烈,Mg、Al跟水在加熱下緩慢反應,Zn、Fe在高溫下跟水氣反應,生成H2和金屬氧化物。
(3)跟鹽酸反應:K、Ca、Na反應猛烈,Mg、Al反應劇烈,鋅、鐵反應較快,Sn、Pb反應緩慢,Cu、Hg、Ag、Pt、Au不能反應。
(4)跟硝酸反應:Cu、Hg、Ag可與HNO3反應,Pt、Au不跟HNO3反應。
2、與金屬有關的特徵的顏色:
有色固體:紅色(Cu、Cu2O、Fe2O3)紅褐色[Fe(OH)3]、藍色[Cu(OH)2、CuSO4·5H2O]黑色(CuO、FeO、FeS、CuS、Ag2S、PbS、Fe3O4)黃色(AgI、AgBr、Ag3PO4、S、Na2O2、FeS2)綠色[FeSO4·7H2O、Cu2(OH)2CO3]
有色溶液:Fe2+(淺綠色)、Fe3+(黃色)、Cu2+(藍色)、MnO4—(紫色)、Fe3+與苯酚(紫色)、Fe3+與SCN-(血紅色)等
3、熟練掌握:NaOH、Na2CO3、NaHCO3;Al3+、AlO2-、Al(OH)3;Fe、Fe2+、Fe3+等三組物質中的三角關係。
教師總結
原子越容易失去電子,還原性越強
1.金屬活動順序表中越靠前,金屬性越強
2.單質與水或非氧化性酸反應越劇烈,金屬性越強
3.單質還原性越強或離子氧化性越弱,金屬性越強
4.最高價氧化物對應水化物的鹼性越強,金屬性越強
5.周期表的位置(同主族,同周期),根據元素性質的族,周期變化判斷
6.形成原電池,做負極材料的為活潑金屬;作正極材料的為不活潑金屬
【典型例題】
[例1]下列金屬冶煉的反應原理,錯誤的是
A、2NaCl(熔融)2Na+Cl2↑B、MgO+H2Mg+H2O
C、Fe3O4+4CO3Fe+4CO2D、2HgO2Hg+O2↑
解析:本題要求掌握隨著不同金屬的陽離子的氧化能力不同,冶煉方法主要有:電解法、還原劑法、加熱法等,我們可以根據金屬活動順序把金屬冶煉的方法規律總結如下:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)Cu、Hg、Ag、Pt、Au、
熔融電解法高溫還原劑法加熱法 金屬陽離子:得電子(氧化性):弱→強 答案:B
[例2]A、B兩種固體,都由甲、乙兩種元素組成。在A、B中,甲、乙兩種元素的原子個數比分別為l∶l和l∶2。高溫煅燒A、B時,產物都是C(固體)和D(氣體)。由D可製得E(酸)。E和另一種酸組成的混合酸跟甲苯反應可生成三硝基甲苯。C與E的稀溶液反應得到溶液F,往F溶液中加入氫氧化鈉溶液,有紅褐色沉澱生成,該沉澱經灼燒後轉變成C。往F溶液中加入甲元素的單質得到溶液G。試根據以上信息填寫下列空白:
(1)A的化學式(分子式)是_____________;
(2)B煅燒生成C和D的化學方程式是;甲元素的單質與F溶液反應的離子方程式是;
(3)往G溶液中加入NaOH溶液發生的現象是。
解析:本題由E和另一種酸組成的混合酸跟甲苯反應可生成三硝基甲苯。作為突破口得E可能為HNO3或H2SO4,然後由酸的製法可判斷該酸為H2SO4,說明A、B中一種元素為S。而根據:“F溶液中加入氫氧化鈉溶液,有紅褐色沉澱生成,該沉澱經灼燒後轉變成C。”可得A、B中另一種物質為鐵Fe。則A為FeS、B為FeS2;甲為Fe、乙為S。依次可推出其他物質:C為Fe2O3、E為H2SO4、F為Fe2(SO4)3、G為FeSO4。
答案:(1)FeS(2)4FeS2+11O22Fe2O3+8SO22Fe3++Fe=3Fe2+
(3)生成的沉澱由白色變成灰綠色最終變成紅褐色。
[例3]Fe3O4可以寫作Fe2O3·FeO,若把Fe3O4看成是一種鹽,又可寫成Fe(FeO2)2。根據化合價規律和化學式書寫方法,把Pb3O4用上述氧化物形式表示,其化學式為________;若看成是一種鹽,化學式為____________。又知,高價Fe不能把HCl氧化,而高價Pb能把HCl氧化成Cl2。試分別寫出Fe3O4、Pb3O4與鹽酸反應的化學方程式。
解析:①鉛(Pb)是ⅣA族元素,化合價只有+2價和+4價。根據Fe3O4寫成Fe2O3·FeO形式,+4價Pb的氧化物寫在前,+2價的氧化物寫在後,則有:PbO2·2PbO。
②又根據Fe3O4看成鹽的形式Fe(FeO2)2分析,低價金屬為陽離子,高價為酸根離子,則Pb3O4可寫成:Pb2(PbO4).
③Fe3+不能氧化HCl,所以Fe3O4與HCl反應生成兩種鹽,屬於複分解反應;而Pb4+有強氧化性,能把HCl氧化成Cl2,這時會生成PbCl2的鹽。
答案:PbO2·2PbO;Pb2(PbO4); Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O
[例4]已知下列各物質都是由短周期元素組成,它們之間的關係如下圖所示:
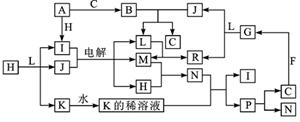
常溫下,A、F為金屬單質,F既能與L溶液反應,又能與N溶液反應。C、H、M為氣體單質,其中H呈黃綠色,A、B、I、K、L、R焰色反應均為黃色。請回答:
(1)P的結構式為,B的電子式為。
(2)R的水溶液呈鹼性的原因可用離子方程式表示為 。
(3)還有一種物質能與B反應生成C,寫出這個反應的化學方程式 。
(4)還有一種物質能與J反應生成C,寫出這個反應的化學方程式。
(5)某氣體Q具有漂白作用,將Q與H等物質的量通入水中所得溶液沒有漂白作用,寫出該過程中發生反應的離子方程式_____________________________________。
解析:本題以鹼金屬元素鈉為中心,覆蓋了氧族、鹵族和鎂、鋁等多種元素的性質。本題突破口為尋找特徵反應和現象:首先應該由焰色反應均為黃色,確定的是A為金屬鈉,黃綠色氣體確定H為Cl2,C、M可能屬於H2、N2、O2和F2中的某一種,考慮到M和H均是電解產生的氣體,顯然M只能是H2,電解的對象為NaCl溶液,即I為NaCl,J為H2O,這樣L只能是NaOH,依次類推可得F是鋁,N為HCl,P為HClO,G為Al2O3,R為NaAlO2,B為Na2O2等。
答案:(1)P的結構式為:H-O-Cl,B為Na2O2,電子式為(略) (2)AlO2-+2H2OAl(OH)3+OH-; (3)2Na2O2+2CO2=2Na2CO3+O2;(4)2F2+2H2O=4HF+O2;
(5)SO2+Cl2+2H2O=4H++SO42-+2Cl-
[例5]鈦(Ti)被稱為繼鐵、鋁之後的第三金屬,鈦白(TiO2)是目前最好的白色顏料。製備TiO2和Ti的原料是鈦鐵礦,我國的鈦鐵礦儲量居世界首位。用含有Fe2O3的鈦鐵礦(主要成分為FeTiO3)製取TiO2的流程如下:
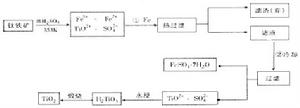
(1)Ti的原子序數為22,Ti位於元素周期表中第_______周期,第______族。
(2)步驟①加鐵的目的是_______________________________________________;
步驟②冷卻的目的是_______________________________________________。
(3)上述製備TiO2的過程中,可以利用的副產物是___________;考慮成本和廢物綜合利用因素,廢液中應加入_________________處理。
(4)由金紅石(TiO2)製取單質Ti,涉及到的步驟為:
已知:①C(s)+O2(g)=CO2(g);△H=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ·mol-1
則TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=_________________。
反應TiCl4+2Mg=2MgCl2+Ti在Ar氣氛中進行的理由是_____________________。
解析:本題考查的是新情境下的工業流程圖,同時還考查了蓋斯定律和元素周期律的有關內容。按照鈦的原子序數(22)可知鈦的電子排布式為:1s22s22p63s23p63d24s2,位於周期表中第四周期,第IVB族。流程中加過量鐵屑的目的是為了將混合物中的Fe3+還原為Fe2+,從而在步驟②冷卻得到較純淨的FeSO4·7H2O晶體。而在廢液中加入石灰(或碳酸鈣、純鹼等)可以中和廢液中的酸,也可以得到副石膏等。而第(4)問則是有關蓋斯定律的內容,①×2-②+③,可得△H=-80kJ·mol-1。TiCl4+2Mg=2MgCl2+Ti,鎂和鈦的金屬活潑性均較強,能與氧氣等物質反應,因此,工業上製取鈦時,應在Ar氣氛中進行,以防氧化。
答案:(1)4IVB(2)將Fe3+還原為Fe2+,析出(或分離、或得到)FeSO4·7H2O
(3)FeSO4·7H2O,石灰(或碳酸鈣、廢鹼);(4)-80kJ·mol-1
防止高溫下Mg(Ti)與空氣中的O2(或CO2、N2)作用
[例6]有鐵粉、三氧化二鐵和氧化銅組成的混合物,投入到110mL4mol/L的鹽酸中,充分作用後得很淺的綠色溶液,產生標準狀況下的氣體896mL,並留下固體1.28g。過濾並將濾液稀釋到200mL,經測定其中含有過量鹽酸為0.4mol/L。試求原混合物中三種物質的質量。
解析:分析該題,反應後溶液為淺綠色,證明溶液中無Cu2+,又鹽酸過量,知留下的固體中無鐵粉,以此可通過得失電子守恆和Cl-守恆列出兩個方程求解。
則:根據題意,可把題中文字和數字的信息改組成如下框信息:
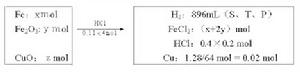
根據Cl—守恆,原鹽酸中的Cl—的物質的量應等於生成物FeCl2中Cl—的物質的量與過量鹽酸中的Cl—的物質的量之和,即:
(x+2y)×2+0.2×0.4=0.11×4┉┉┉①
氧化劑Fe2O3→2Fe2+、CuO→Cu、2H+→H2↑
還原劑Fe→Fe2+
根據氧化劑得電子總數等於還原劑失電子總數,得
2y+(1.28/64)×2+(896/22400)×2=2x┉┉┉②
解方程組①與②得:x=0.1(mol),y=0.04(mol)。
即原混合物中,Fe粉為5.6g,Fe2O3為6.4g,CuO為1.6g。
答案:Fe粉為5.6g,Fe2O3為6.4g,CuO為1.6g
【模擬試題】
1、某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其c(H+)=10-2mol·L-1,在該溶液中可以大量存在的陰離子是:
A、SO42-B、NO3-C、SCN-D、CO32-
2、向FeCl3和BaCl2的酸性混合溶液中,通入SO2氣體,有白色沉澱生成。此沉澱是:
A、BaSO4B、FeSC、Baso3D、S
3、在理論上我們可以用電解熔融KCl的方法來製備金屬鉀,而實際上,在工業生產中並不採用此法,而用熔融狀態下的KCl和Na反應並及時抽走鉀蒸氣的方法製備鉀,可能的原因是:①鉀的沸點比Na低;②鉀蒸氣易逸出而污染環境;③鉀被氧化後的產物與K作用具有爆炸性;④抽走鉀的蒸氣有利於鈉與熔融KCl的反應,其中正確的是:
A、全部B、①③C、①④D、②④
4、有關碳酸氫鈉和碳酸鈉的性質,以下敘述錯誤的是:
A、等質量的碳酸氫鈉和碳酸鈉與足量鹽酸反應,在相同條件下碳酸鈉產生的二氧化碳體積大
B、等物質的量的兩種鹽與同濃度的鹽酸完全反應,碳酸鈉所消耗鹽酸的體積是碳酸氫鈉的兩倍
C、將石灰水加入碳酸氫鈉溶液中不產生沉澱,加入碳酸鈉溶液中產生白色沉澱
D、同物質的量濃度的兩種溶液,碳酸鈉溶液的pH大於碳酸氫鈉溶液
5、向某晶體的溶液中加入Fe2+的溶液無明顯變化,當滴加幾滴溴水後,溶液變成紅色,由此得出的結論錯誤的是:
A、Fe2+的氧化性比溴的氧化性強
B、該晶體中一定含有SCN-
C、Fe2+與SCN-不能形成紅色化合物
D、Fe2+被溴氧化成Fe3+
6、將amolAl203和bmolMgO混合後全部溶於VL過量的稀H2SO4中,然後再逐滴加入0.5mol/L的NaOH溶液,當加至xLNaOH溶液時,生成的沉澱量最大。則原稀H2S04的物質的量濃度是:
A、mol/LB、mol/L
C、mol/LD、無法計算
7、下列框圖中,A~M所代表的物質為中學化學常見的物質,其中A~F為單質;通常情況下,A、F為固體,B為黃綠色氣體,C、D、E為無色氣體,F可溶於強鹼的溶液。在一定條件下相互轉化關係如圖所示(圖中部分反應條件的產物已略去。)
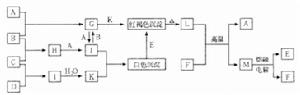
請按要求回答問題。
(1)寫出化學式:A,B,C,D。
(2)I的電子式為,I與E在催化劑(如鉑等)存在的條件下,發生反應的化學方程式為。
(3)將G的水溶液加熱、蒸乾、灼燒,最後得到的固體是;G與K反應的離子方程式為。
(4)寫出下列反應的化學方程式:
①L+F→A+M。
②M→E+F。
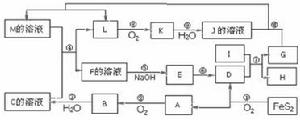
8、下圖是無機物A~M在一定條件下的轉化關係(部分產物及反應條件未列出)。其中,I是由第三周期元素組成的單質中熔點最高的金屬,K是一種紅棕色氣體。
 8
8請填寫下列空白:
(1)在周期表中,組成單質G的元素位於第________周期_______族。
(2)在反應⑦中氧化劑與還原劑的物質的量之比為___________________。
(3)在反應②、③、⑥、⑨中,既屬於化合反應又屬於非氧化還原反應的是_______。
(4)反應④的離子方程式是:_______________________________________。
(5)將化合物D與KNO3、KOH共融,可製得一種“綠色”環保高效淨水劑K2FeO4(高鐵酸鉀)。同時還生成KNO2和H2O。該反應的化學方程式是:_____________________。
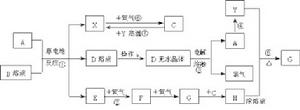
9、已知A為常見金屬,X、Y為常見非金屬,X、E、F、G常溫下為氣體,C為液體,B是一種鹽,受熱極易分解,在工農業生產中用途較廣(如被用作某些電池的電解質)。現用A與石墨作電極,B的濃溶液作電解質,構成原電池。有關物質之間的轉化關係如下圖:
(注意:其中有些反應的條件及部分生成物被略去)
請填寫下列空白:
(1)反應④為A在某種氣體中燃燒,生成單質Y和A的氧化物,其反應方程式為
(2)從D溶液製備D的無水晶體的“操作a”為。
(3)反應②的化學方程式為。
(4)反應⑤的化學方程式為 。
(5)原電池反應①中正極的電極反應式為。
 10
1010、最近,我國利用生產磷銨排放的廢渣磷石膏製取硫酸並聯產水泥的技術研究獲得成功。具體生產流程如下:
回答下列問題:
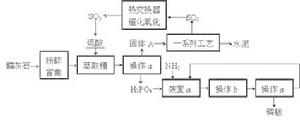 tu
tu(1)若操作a、操作b均在實驗室進行,則操作a時用到的玻璃儀器有 ;進行操作b時需注意.(2)裝置a用於磷酸吸收NH3。若該過程在實驗室中進行,請在下面的方框內畫出裝置a的示意圖。
 圖
圖(3)熱交換器是實現冷熱交換的裝置。化學實驗中也經常利用熱交換來實現某種實驗目的,如氣、液熱交換時通常使用的儀器是。
(4)固體A為生石膏(CaSO4·2H2O)和不含結晶水且高溫時也不分解的雜質。生石膏在120℃時失水生成熟石膏(2CaSO4·H2O),熟石膏在200℃時失水生成硫酸鈣。
為測定固體A中生石膏的含量,某科研小組進行了如下實驗:稱取固體A180g置於坩堝中加熱,加熱過程中固體質量隨溫度變化記錄如圖:
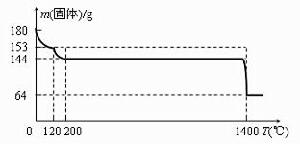 圖
圖①實驗中每次對固體稱量時須在冷卻後進行。為保證實驗結果的精確性,固體冷卻時必須防止 。
②將加熱到1400℃時生成的氣體通入品紅溶液中,品紅褪色。寫出1400℃時的化學反應方程式 。
③固體A中生石膏的質量百分含量=。
教學流程圖
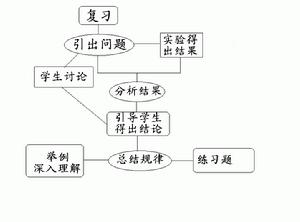 1
1教學評價備註與反思
本節課從實驗對比和理論分析入手,總結出了鹼金屬元素性質的相似性及遞變規律。教師在講述本節課的同時,要特別注意啟發,引導學生從物質的結構入手來分析物質的性質並逐漸使學生學會比較的學習方法,以此來培養學生分析問題、解決問題的能力,為以後學習元素周期律知識打下良好的基礎。
教學評價表
高二年級 班 姓名: 學號:
在你認為對的地方打“√”
| 評價內容 | 自我評價 | 小組互評 | ||||
| 選答 | A | B | C | A | B | C |
| 預習工作 | ||||||
| 專心程度 | ||||||
| 小組合作 | ||||||
| 環保措施 |
