簡介
核酸探針(又稱基因探針,gene-probe)技術,是20世紀晚期在生物學領域中發展起來的一項新技術,除可用於病毒、細菌等微生物的快速診斷外,還可用於研究病毒基因在組織細胞中的存在,研究基因是以游離的形式還是以整合的方式與宿主細胞DNA結合,研究基因在細胞或組織中的定位等。
原理
核酸探針技術原理是鹼基配對。互補的兩條核酸單鏈通過退火形成雙鏈,這一過程稱為核酸雜交。核酸探針是指帶有標記物的已知序列的核酸片段,它能和與其互補的核酸序列雜交,形成雙鏈,所以可用於待測核酸樣品中特定基因序列的檢測。每一種病原體都具有獨特的核酸片段,通過分離和標記這些片段就可製備出探針,用於疾病的診斷等研究。主要種類
(一) 核酸探針的種類
1.按來源及性質劃分 可將核酸探針分為基因組DNA探針、cDNA探針、RNA探針和人工合成的寡核苷酸探針等幾類。
作為診斷試劑,較常使用的是基因組DNA探針和cDNA探針。其中,前者套用最為廣泛,它的製備可通過酶切或聚合酶鏈反應(PCR)從基因組中獲得特異的DNA後將其克隆到質粒或噬菌體載體中,隨著質粒的複製或噬菌體的增殖而獲得大量高純度的DNA探針。將 RNA進行反轉錄,所獲得的產物即為cDNA。cDNA探針適用於RNA病毒的檢測。cDNA探針序列也可克隆到質粒或噬菌體中,以便大量製備。
將信息RNA(mRNA)標記也可作為核酸分子雜交的探針。但由於來源極不方便,且RNA極易被環境中大量存在的核酸酶所降解,操作不便,因此套用較少。
用人工合成的寡聚核苷酸片段做為核酸雜交探針套用十分廣泛,可根據需要隨心所欲合成相應的序列,可合成僅有幾十個bp的探針序列,對於檢測點突變和小段鹼基的缺失或插入尤為適用
2.按標記物劃分 有放射性標記探針和非放射性標記探針兩大類。放射性標記探針用放射性同位素做為標記物。放射性同位素是最早使用,也是目前套用最廣泛的探針標記物。常用的同位素有32P、3H、35S。其中,以32P套用最普遍。放射性標記的優點是靈敏度高,可以檢測到Pg級;缺點是易造成放射性污染,同位素半衰期短、不穩定、成本高等。因此,放射性標記的探針不能實現商品化。目前,許多實驗室都致力於發展非放射性標記的探針。
目前套用較多的非放射性標記物是生物素(Biotin)和地高辛(digoxigenin)。二者都是半抗原。生物素是一種小分子水溶性維生素,對親和素有獨特的親和力,兩者能形成穩定的複合物,通過連線在親和素或抗生物素蛋白上的顯色物質(如酶、螢光素等)進行檢測。地高辛是一種類固醇半抗原分子,可利用其抗體進行免疫檢測,原理類似於生物素的檢測。地高辛標記核酸探針的檢測靈敏度可與放射性同位素標記的相當,而特異性優於生物素標記,其套用日趨廣泛。
檢驗的特點
雙股RNA比雙股DNA更穩定,雜交後,經嚴格沖洗,可洗去非特異結合的探針,還可用RNA酶來降解未雜交的RNA,小的RNA分子比大的DNA分子更易擴散進入薄膜,在原位雜交中獲得更大的信號與本底比率(signaltonoiseratio),由此可見,用核酸探針檢測具有很大的優點。
對於不易分離培養的微生物標本,及大量培養增殖後有“危險性”的病毒標本,均可用核酸探針直接檢測。另外,對病毒子或病毒抗原太少的標本,不易用常規方法,包括電鏡和血清學方法檢測的標本,也可用核酸探針檢測。本法還可用於對變異株病毒等的鑑定。
核酸探針的標記
1.放射性同位素標記法 常將放射性同位素如32 P連線到某種脫氧核糖核苷三磷酸(dNTP)上做為標記物,然後通過切口平移法標記探針。
切口平移法(nick translation)是利用大腸桿菌DNA聚合酶I (E.coli DNA polymerase I) 的多種酶促活性將標記的dNTP摻入到新形成的DNA鏈中去,形成均勻標記的高比活DNA探針。其操作方法如下:
(1) 取1?g DNA溶於少量無菌雙蒸水中,加入5?l距離大約10×切口平移緩衝液 ( 0.5mol/L Tris-HCl,PH7.2;0.1 mol/L MgSO4 ;1mmol/L二硫蘇糖醇;500?g/mL牛血清白蛋白),加入除標記物(如?-32 p-datp)外的其它三種dNTP(如dCTP,dGTP,dTTP)溶液,20mmol/L溶液各1?l。
(2) 加入100?ci(10?l)標記物溶液,加入無菌雙蒸水至終體積為46.5?l,混勻,加入0.5?l稀釋的DNaseI溶液,混勻;加入1?l(約5單位)E.coli DNA polymerase I,混勻。
(3) 置14-16℃反應1-2小時。
2.非放射性標記法 可將生物素、地高辛連接在dNTP上,然後象放射性標記一樣用酶促聚合法摻入到核酸鏈中製備標記探針。也可讓生物素、地高辛等直接與核酸進行化學反應而連線上核酸鏈。其中,生物素的光化學標記法較為常用。其原理是利用能被可見光激活的生物素衍生物-光敏生物素(photobiotin),光敏生物素與核酸探針混合後,在強的可見光照射下,可與核酸共價相連,形成生物素標記的核酸探針。可適用於單、雙鏈DNA及RNA的標記,探針可在-20℃下保存8-10個月以上。具體操作方法如下:
(1) 將雙鏈DNA變性或用NaOH處理形成缺口,單鏈DNA或RNA毋需處理,將核酸樣品溶於水。
(2) 暗室下在微量離心管中加入10?g DNA,1mg/ml光敏生物素20?l,加水至50?l,混勻。
(3) 冰浴中打開離心管蓋,在300-500瓦燈下照射10分鐘(液面距燈泡10cm)。
(4) 加入100?l 0.1mol/L Tris-HCl,pH8.0,加入100?l 2-丁醇抽提兩次,離心,棄上層。
(5) 乙醇沉澱核酸探針;用70%乙醇漂洗真空抽乾,備用。
除上述標記法外,探針的製備和標記還可通過PCR反應直接完成。
(三) 核酸雜交 雜交技術有固相雜交和液相雜交之分。固相雜交技術目前較為常用,先將待測核酸結合到一定的固相支持物上,再與液相中的標記探針進行雜交。固相支持物常用硝酸纖維素膜(nitrocellulose filter membrane,簡稱NC膜)或尼龍膜(nylon membrane)。
固相雜交包括膜上印跡雜交和原位雜交。前者包括三個基本過程:第一,通過印跡技術將核酸片段轉移到固相支持物上;第二,用標記探針與支持物上的核酸片段進行雜交;第三,雜交信號的檢測。
用探針對細胞或組織切片中的核酸雜交並進行檢測的方法稱之為核酸原位雜交。某特點是靶分子固定在細胞中,細胞固定在載玻片上,以固定的細胞代替純化的核酸,然後將載玻片浸入溶有探針的溶液里,探針進入組織細胞與靶分子雜交,而靶分子仍固定在細胞內。例如。可用特異性的細菌、病毒的核酸做為探針對組織、細胞進行原位雜交,以確定有無該病原體的感染等。原位雜交不需從組織中提取核酸,對於組織中含量極低的靶序列有極高的敏感性,在臨床套用上有獨特的意義。
近年來液相雜交技術有所發展。液相雜交與固相雜交的主要區別是不用純化或固定的靶分子,探針與靶序列直接在溶液里作用。液相雜交步驟有所簡化,雜交速度有所提高,增加了特異性和敏感性,但與臨床診斷所要求的特異性和敏感性還有一定的距離。
各種雜交技術中,膜上印跡雜交技術套用最為廣泛,它由以下三個基本過程組成。
1.核酸印跡技術
(1) 斑點印跡(Dot-blot) 將待測核酸樣品變性後直接點樣在膜上,稱之為斑點印跡。為使核酸牢固結合在膜上,通常還將點樣後的膜進行80℃真空烘烤2h。
套用斑點印跡技術,可在一張膜上同時進行多個樣品的檢測,操作簡便、快速,在臨床診斷中套用較廣。適合進行特定基因的定性及定量研究,但不能鑑定所測基因的分子量。
(2) Southern印跡(Southern blot) 這是指將DNA片段經瓊脂糖凝膠電泳分離後轉移到固相支持物上的過程。
常規處理如下,先用限制性內切酶對DNA樣品進行酶切處理,經瓊脂糖凝膠電泳將所得DNA片段按分子量大小分離,接著對凝膠進行變性處理,使雙鏈DNA解離成單鏈,並將其轉移到NC膜或其它固相支持物上,轉移後各DNA片段的相對位置保持不變。用探針與經Southern印跡處理的DNA樣品雜交,可鑑定待測DNA的大小、進行克隆基因的酶切圖譜分析、基因組基因的定性及定量分析、基因突變分析及限制性片段長度多態性分析(RFLP)等。
Southern印跡的操作方法有三種:
① 毛細管轉移(或虹吸印跡)。這是一傳統方法,進行毛細管轉移時,DNA片段由液流攜帶從凝膠轉移到固相支持物表面。安放裝置時,在轉移槽中央的平台上由下到上依次疊放變性凝膠、濾膜、一疊乾的吸水紙巾;凝膠與轉移緩衝液通過一紙橋連線;濾膜上的紙巾吸水而產生並維持毛細管作用,液體由於毛細管作用抽吸通過凝膠,並將DNA片段攜帶聚集在濾膜上。DNA片段的大小和瓊脂的濃度決定了轉移的速度。小片段DNA(<1kb)在1小時內可從 0.7%瓊脂糖凝膠上幾乎定量轉移,而大片段DNA的轉移較慢且效率較低,如大於15kb的 DNA片段需要18小時而轉移尚不完全。
② 電轉移。利用電場的電泳作用將凝膠中的DNA轉移到固相支持物上,可達到簡單、迅速、高效的目的。一般2-3小時內可轉移完畢。電轉法不宜採用NC膜,因為NC膜結合 DNA依賴高鹽溶液,而高鹽溶液在電泳過程中會破壞緩衝體系,使DNA損傷。一般使用化學活化膜和正電荷修飾的尼龍膜。此外,電轉過程中轉移體系的溫度升高,必須使用循環冷卻水。商業化的電轉儀一般附有冷卻設備,也可在冷室中進行。具體操作時,按儀器使用說明安裝電轉裝置,將變性凝膠夾在轉移膜內平行電極內側的多孔板之間,排除夾層間氣泡,加入轉移緩衝液並通電進行電轉。
③ 真空印跡法 這是近年來發展起來的一種簡單、快速、高效的DNA和RNA印跡法。其基本原理是利用真空作用將轉膜緩衝液從凝膠上層的容器抽到下層,凝膠中的核酸片段將隨緩衝液移置到凝膠下面的固相支持物上。這一方法的最大優點是快速高效,可在轉膜的同時進行DNA的變性與中和,30分鐘至1小時可完成,適合檢疫工作的要求。已有商業化的真空轉移儀提供,可按商品使用說明進行操作。
Southern印跡後的濾膜仍需進行固定處理,對NC膜可用80℃真空烘烤2小時,對尼龍膜還可用短波紫外線(波長254nm)照射幾分鐘。
(3) Northern印跡(Northern blot) Northern印跡是指將RNA片段變性及電泳分離後,轉移到固相支持物上的過程。RNA樣品經Northern印跡後進行雜交反應可鑑定其中特異 mRNA分子的量與大小。
Northern印跡的方法與Southern印跡基本相同,可參照進行。但RNA的變性方法與 DNA不同。DNA樣品可先通過凝膠電泳進行分離,再用鹼處理凝膠使DNA變性。而RNA不能用鹼變性,因為鹼會導致RNA水解。因此,在Northern印跡前,須進行RNA變性電泳,在電泳過程中使RNA解離形成單鏈分布在凝膠上,再進行印跡轉移。
RNA變性電泳的原理,是用一定劑量的乙二醛-二甲基亞礬,或甲醛和甲基氫氧化汞等處理RNA樣品和凝膠,使雙鏈RNA在電泳過程中變性而完全解離形成單鏈。
2.雜交反應的基本過程 雜交反應包括預雜交、雜交和漂洗幾步操作。
預雜交的目的是用非特異性DNA分子(鮭精DNA或小牛胸腺DNA)及其它高分子化合物(Denhart’s溶液)將待測核酸分子中的非特異性位點封閉,以避免這些位點與探針的非特異性結合。雜交反應是使單鏈核酸探針與固定在膜上的待測核酸單鏈在一定溫度和條件下進行復性反應的過程。雜交反應結束後,應進行洗膜處理以洗去非特異性雜交以及未雜交的標記探針,以避免干擾特異性雜交信號的檢測。膜洗淨後,將繼續進行雜交信號的檢測。
(1) 以放射性標記探針與固定在NC膜上的核酸進行雜交為例,雜交反應操作如下:
① 配製所需試劑
SSC溶液(20×):3mol/L NaCl,0.3mol/L檸檬酸鈉。
Denhardt’s溶液(50×):聚蔗糖5g,聚乙烯吡咯烷酮5g,牛血清白蛋白(BSA)5g加水至500ml。
預雜交液:6×SSC,5×Denhardt’s溶液,0.5%SDS,100?g/ml經變性或斷裂成片段的鮭精DNA。
② 將含靶核酸的NC膜漂浮於6×SSC液面,使其由下至上完全濕潤,並繼續浸泡2分鐘。
③ 將濕潤NC膜裝入塑膠袋中,按0.2ml/cm2的量加入預雜交液,儘可能擠出氣泡,將袋封口,置68℃水浴1-2小時或過夜。
④ 將雙鏈探針做變性處理使成單鏈,即於100℃加熱5分鐘,然後立即置冰浴使驟冷。
⑤ 從水浴中取出雜交袋,剪去一角,將單鏈探針加入,儘可能將袋內空氣擠出去,重新封口,並將雜交袋裝入另一個乾淨的袋內,封閉,以防放射性污染。
⑥ 將雜交袋浸入68℃水浴,溫育8-16小時。
⑦ 取出雜交袋,剪開,取出濾膜迅速浸泡於大量2×SSC和0.5%SDS中,室溫振盪5分鐘,勿使濾膜乾燥。
⑧ 將NC膜移入盛有大量2×SSC和0.1%SDS溶液的容器中,室溫漂洗15分鐘。
⑨ 將NC膜移入一盛有大量0.1×SSC和0.5%SDS溶液的容器中,37℃漂洗30分鐘至1小時。
⑩ 將NC膜移入一盛有新配0.1×SSC和0.5%SDS溶液的容器中,68℃漂洗30分鐘至1小時。
⑾ 取出濾膜,用0.1×SSC室溫稍稍漂洗,然後置濾紙上吸去大部分液體,待做雜交信號的檢測。
3雜交信號的檢測 當探針是放射性標記時,雜交信號的檢測通過放射自顯影進行。即利用放射線在X光片上的成影作用來檢測雜交信號。操作時,在暗室內將濾膜與增感屏、X光片依序放置暗盒中,再將暗盒置-70℃曝光適當時間,取出X光片,進行顯影和定影處理。
對於非放射性標記的探針,則需將非放射性標記物與檢測系統偶聯,再經檢測系統的顯色反應來檢測雜交信號。以地高辛的鹼性磷酸酶檢測反應為例,地高辛(Dig)是一種半抗原,雜交反應結束後,可加入鹼性磷酸酶標記的抗Dig抗體,使之在膜上的雜交位點形成酶標抗體Dig複合物,再加入酶底物如氮藍四唑鹽(NBT)和5-溴-4-氯-3-吲哚酚磷酸甲苯胺鹽(BCIP),在酶促作用下,底物開始顯藍紫色。其基本反應程式類似ELISA,雜交信號的強弱,通過底物顯色程度的深淺、有無來確定。
(四) 核酸探針技術在動物檢疫中的套用 核酸探針技術是目前分子生物學中套用最廣泛的技術之一,是定性或定量檢測特異RNA或DNA序列的有力工具。核酸探針可用以檢測任何特定病原微生物,並能鑑別密切相關的毒 (菌)株和寄生蟲。目前,各種常見病毒病的診斷和研究都已套用到核酸探針技術,這方面的研究報導數以萬計且與日俱增。但該項技術的操作畢竟比常規方法複雜,費用較高,在動物檢疫中尚未推廣。多在實驗室內對病原作深入研究時使用。
套用
1.鑑定特異性目的基因及外源DNA的檢測
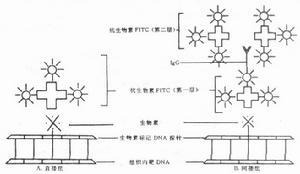
在基因工程中,含有特異性目的基因的重組子,可通過核酸分子雜交進行鑑定。生物工程產品中殘留的宿主細胞DNA是一種潛在的與工藝相關的雜質。各種產品中所含的殘留DNA,取決於所用的突破主微生物(細菌或細胞)和生產該產品的回收工藝。例如:DNA或其降解片斷,可以被陰離子交換劑(DEAE-SepharoseFF,MonoQ等)吸附,洗脫時混入到蛋白級分中。現雖還沒有因使用含DNA的生物製品而影響人體健康的報導,但管理部門則要求生產者控制生物工程產品中的DNA含量,使之保持在低水平。我國衛生部制定了相應規定;美國藥典、英國藥典和世界衛生組織的檔案均有相應的規程和方法;均要求每一劑量製品所含殘留DNA的量不得大於100pg(10-12g),但測定方法並無具體細節。國內有些單位已開展了此項工作。我們採用非同位素法,以長臂光敏生物素標記核酸探針,通過分子雜交檢測殘留DNA。方法的檢測靈敏度為2PG,符合100pg/劑量的標準要求。
2.基因診斷方面的套用
以基因探針雜交和基因體外擴增兩項技術為主幹,以轉印、電泳、限制性酶切乃至DNA測序、基因拼接等技術為輔助,使基因診斷逐步成長為一套有廣泛用途的、高靈敏度(ag級)、高特異性(能查明一個核苷酸的差異)的醫學生物學診斷手段,不同模式的基因診斷可以隨需要而任意選用,例如:
(1)斑點或條狀雜交模式。適用於大批量標本的檢測,如普查、獻血員初篩等場合,每人每天的檢測可以達到1000個標本以上,如果輔以半自動的樣品處理、分子雜交儀等檢測數則可增加數倍,對含多拷貝重複序列的瘧原蟲檢測可達高靈敏度。
(2)探針雜交模式將不可替代地用於原位雜交、菌落或細胞群落的轉印雜交篩選,用於檢測片段中的點突變(示並差雜交),用作探針來親和(雜交)分離含互補序列的片段等。
(3)PCR-EB,PCR-SCB,套式二次PCR,套式一次PCR,則可用於需要不同靈敏度和特異性的檢測。
基因診斷的套用範圍正在不斷擴大之中,在以下幾個領域中具有實用價值:
(1)遺傳病的產前診斷。用胎兒羊膜細胞、羊水甚至母血可以檢測胎兒的性別,這在與性染色體關聯遺傳病診斷中是必要的。對於高發的遺傳病如地中海貧血、鐮刀狀貧血、凝血因子缺乏、DMD等已在臨床套用多年,為優生優育作了貢獻。對於有遺傳傾向的疾病尤其是老年性疾病,如糖尿病、高血脂症,甚至部分腫瘤,均是當前研究的重點,近期內可有突破。
(2)致病病原體的檢測。這些外源入侵的基因,一旦闡明其部分核酸序列,就可以設計引物和探針,用PCR、RT-PCR或雜交方法來檢測,其範圍包括細菌、病毒、原蟲及寄生蟲、黴菌、立克次體、衣原體和支原體等一切微生物。基因診斷的特點是可以其基因中的保守區做通用檢測,也可以選定差異較大的基因部位做分型檢測;即可以做單一病原體的專用檢測,也可以將有關的病毒、細胞中不同的品種做一次多元檢測,而且檢測的靈敏度和特異性都遠高於當前的免疫學方法,所需時間已達到臨床要求。這對於難以培養的病毒(如HBV)、細菌(如結核、厭氧菌)和原蟲(如梅毒螺鏇體)等來說尤為適用。
(3)癌基因的檢測和診斷。雖然對癌基因的研究大部分還屬於基礎階段,但癌變是由基因變化所導致的這一基本事實已毋庸置疑。所以癌基因、抗癌基因及癌轉移基因的研究,離開分子水平的診斷手段是無法進行的。臨床上已可套用的例子有白血病殘留細胞的定量(包括慢粒和急淋);肺癌中p53及Rb等抗癌基因的失活;神經膠質瘤中N-MIC基因的激活和表達。通過原位雜交觀察特定癌基因及抗轉移基因的植入和反義寡核苷酸對強表達癌基因的陰斷均已成為近代基因治療的著眼點。
(4)DNA指紋,個體識別,親子關係鑑別及法醫物證。這一為公、檢、法部門所矚目的課題已經在某些國家取得法律認可。肌紅蛋白小衛星體基因、珠蛋白基因、ApoB基因等的多態性和重複次數的差異都被套用於鑑定,其靈敏度已達到一根頭髮、一個細胞、一個精子取得個體特徵圖譜,這一領域也已發展到骨髓或臟器移植配型乃至動物種系的研究等。
(5)動、植物檢疫。靈敏、特異、快速診斷檢測方法是國進出口口岸的門衛。檢查出入國門的人員、動植物(種畜、種籽)等是否攜帶烈性傳染病(愛滋、動植物病毒等)病原體,食品、飲料等否帶沙門氏菌等,均需要基因診斷手段將這些病菌拒之國門之外,基因診斷是提高我國綜合國力的必要保證。
(6)高科技生物醫學領域中的套用。在轉基因動植物中檢查植入基因的存在。PCR技術尚可提高我國綜合國力的必要保證。
發展前景
近年來,隨著人們對基因精細結構的深入細緻的研究和DNA合成技術的發展,已經能夠人工合成寡聚核苷酸片段作為探針來使用。這樣由於DNA探針來源比較豐富,所以,可提高探針濃度來縮短雜交時間。Rubin等用Whatman541濾紙代替硝酸纖維素膜進行菌落雜交試驗,使操作過程方便簡單,並且可取消預雜交。非放射性標記物——生物素,正日益引起人們極大的興趣,是今後的發展方向。分子生物學實驗技術
| 分子生物學(molecularbiology) 是從分子水平研究作為生命活動主要物質基礎的生物大分子結構與功能,從而闡明生命現象本質的科學。而分子生物學的各種實驗方法,是本學科得以高速發展和不斷取得突破性成就的基礎。隨著學科的發展和各相關交叉學科的進步,分子生物學實驗技術必定會越來越高效與精準,成為人類探索自然、改善自然的有力工具。 |