病症簡介
 希恩綜合徵
希恩綜合徵產後垂體壞死引起者,稱為希恩綜合徵(Sheehan’s Syndrome),泛稱之為席漢氏綜合徵,常見的是在產後大出血或產褥感染伴休克或昏厥,隨之出現垂體功能減退等一系列症候群。其臨床表現為極度體力衰竭、產後無乳、貧血、漸進出現性徵退化、閉經、毛髮及牙齒脫落,性慾減退、畏寒、皮膚乾燥等,嚴重者每有暈厥,甚至無明顯誘因突然死亡。中醫無相應病名,根據臨床表現,似可歸屬於“產後虛勞”、“閉經”、“產後血暈”、“勞瘠”等範疇。
病因病理
 希恩綜合徵
希恩綜合徵 中醫對本病的認識,從其病史及臨床表現可歸於“產後虛勞”、“產後血暈”、“閉經”、“血枯經閉”、“勞瘠”等範疇。巢元方《諸病源候論》中的“產後虛贏侯”中曰“夫產損動臟腑,勞傷氣血……故虛贏也,將養失所,多沉滯勞瘠,甚傷損者皆著床,此勞瘠也。”這與本病的病理機制和臨床特徵是十分接近的。本病的病因比較明了,病機較為複雜,按“辨證求因”原則分為虛、實兩端,但絕大多數屬虛。一般認為,主要病因為產後大出血,氣隨血脫,血少而不生精,致氣耗津傷,血脫脈空,臟腑失卻濡潤,沖任虛衰,血海不充,胞宮失養,以致出現月事不下,毛髮脫落,性慾減退,腰酸乏力等一系列虛勞表現,以此徵象亦可確知在前有精血耗損之由。腎藏精,多產、墮胎、房勞或久病及腎,腎失所藏而虛損。腎陰虛和腎陽虛的本質都是腎之精氣不足,而腎陰腎陽之間又相互制約、相互依存,維持著相對的動態平衡,一旦一方有所偏盛或偏衰,則會出現彼此損及的病理狀態,故希恩綜合徵初見腎之精血不足,久則一派虛寒之腎陽虛見證。腎脾為先後天之本,腎為脾先天之源,脾為腎後天之充,它們相互依賴、相互滋生,腎陽不足則脾失溫煦,故脾陽亦衰,而臨床亦不獨有腎陽虛,脾腎陽虛為最常見證型。肝藏血,受腎水涵養,血虛與腎陰不足,致肝失水涵血養,肝血虛少,沖任失於充養,源斷其流,女子以肝為先天,肝血虛極則有生殖器萎縮,與性腺有關的組織退化等症狀。
臨床表現
 希恩綜合徵
希恩綜合徵 病至後期出現一系列氣血雙虧、腎、脾、肝等髒均不足的臨床表現。
1.脾腎陽虛,沖任不盛。腎藏精,精化血,為先天之本;脾統血,主運化,為後天之本。脾腎陽氣互相資助,分娩大出血,脾虛血少,運化無權,化源不足,精虧血虛,沖任失養,而致虛勞、血枯經閉。
2.氣血虛弱,血海無餘。產後失血傷津,損及臟腑,沖任不盛,血海空虛,發為虛勞、經閉。
3.肝腎虛損,津虧血少。肝藏血,腎藏精,肝腎同源,為沖任之本。產後大出血,精虧血虛,損傷沖任,沖脈不盛,任脈不通,遂成虛勞、經閉。
4.腎陽不足,命門火衰。分娩大出血,氣隨血脫,陽氣衰微,命火不足,溫煦無能,腎精虧耗,沖任失養,而發虛勞、血枯經閉。
綜上所述其病機主要為氣血虛損,脾腎陽虛,肝腎虧損,尤以腎虛為發病關鍵。
相關檢查
(1)血常規、血電解質、血糖測定:垂體功能減退性昏迷可由於昏迷的逐漸出現而被誤診為腦血栓形成,由於頸部強直而誤診為腦膜炎,由於抽搐而被誤診為癲癇,由於脈搏緩慢而被誤診為心源性腦缺血綜合徵(阿-斯綜合徵),由於飢餓性酮尿而誤診為糖尿病昏迷,由於曾服用麻醉藥而誤診為麻醉藥中毒等。在臨床上凡遇到原因不甚明確有昏迷患者,皆應提高警惕,考慮到垂體功能減退的可能性,而作詳細的病史詢問和全面檢查。
(2)腺垂體激素及靶腺測定。
(3)必要時可進行腺垂體儲備功能測試,如刺激生長激素(GH)、泌乳素(PRL)、胰島素低血糖試驗(有一定危險性,需仔細監測血糖)、黃體生成素釋放激素(LHRH)興奮試驗、TRH興奮試驗。
(4)疑有占位病變者,可作眼底檢查、視野檢查、頭顱正、側位片、CT、磁共振檢查。
併發症
 希恩綜合徵
希恩綜合徵 1.合併糖尿病
腺垂體功能減退症的病因,多為產後出血所致的垂體壞死,或為垂體遷徙性膿腫壞死、結節病累及垂體以及癌腫浸潤垂體。不少病例的病因與全身性動脈硬化累及垂體、造成血栓形成有關。糖尿病的血管損害可能為發病的基礎。臨床表現按腺垂體功能減退症出現的緩急,可分為兩型:
(1)慢性型:表現為糖尿病病人在治療過程中變得對胰島素特別敏感,易於出現低血糖,對胰島素的需要量減少,並逐漸出現腺垂體功能減退症的各種表現。
(2)急性型:腺垂體功能減退症的起病急驟,由於垂體內出血或垂體膿腫和急性壞死等引起,病人除垂體局部病變所致的症狀外,常表現為糖尿病驟然消失,發生低血糖昏迷。
糖尿病病人並發腺垂體功能減退症後,視網膜血管病變可好轉,大約與生長激素的消除有關。生長激素可加重糖尿病的血管病變,因而可以用垂體切除術治療糖尿病時的視網膜病變。
2.合併尿崩症
下丘腦或垂體部位的手術、腫瘤、炎症等,可同時引起尿崩症和腺垂體功能減退。引起產後腺垂體壞死的血管病變,有時也可損及視上核神經垂體束而並發尿崩症。腺垂體功能減退對尿崩症的病情有顯著影響,合併此病後,多尿減輕,尿滲透壓也較高;病人的腎小球濾過率降低,腎臟濃縮及稀釋功能都受到限制,排泄水負荷的能力減弱;尿量取決於溶質的排泄量。發生此種現象的主要原因是糖皮質激素缺乏。糖皮質激素似與抗利尿激素有拮抗作用,但作用方式還未明確。有人認為糖皮質激素可抑制抗利尿激素的分泌,也有人認為糖皮質激素可能作用於腎臟,阻止集合管內水分的返回彌散。因此,當糖皮質激素缺乏時,抗利尿激素缺乏的現象也減輕。此外,糖皮質激素及甲狀腺素減少時,溶質的排泄減少,也是使多尿減輕的一個原因。臨床上需注意,有此兩種病況合併存在時,補充糖皮質激素後,尿崩症的症狀加重,對於加壓素的需要量增多。對於原來只有尿崩症的病人,如病情減輕,要考慮發生腺垂體功能減退症的可能性。
3.合併妊娠
輕型腺垂體功能減退症的病人,尤其是經過甲狀腺、腎上腺皮質和性腺的激素補充治療後,偶爾可以妊娠。這可能是在激素補充治療後,使機體的代謝狀況改善,殘餘的垂體組織恢復了部分功能之故。妊娠期間,由於胎盤可產生多種激素,垂體組織也可增生,故腺垂體功能減退症的表現可減輕。在分娩時,需密切注意避免危象的發生,必要時應補充腎上腺皮質激素。分娩之後,腺垂體功能減退症可好轉,但也可能恢復到原來的狀況甚至加重。
4.可並發感染、垂體危象及昏迷。
垂體危象、昏迷的治療:低血糖者套用50%葡萄糖溶液,靜注,繼以10%葡萄糖溶液500ml加氫化可的松100~200mg靜滴。有感染、循環衰竭、低血壓、休克時補充需要量的葡萄糖鹽水加氫化可的松、抗生素、升壓藥靜滴,必要時輸血。低體溫者應保溫、套用三碘甲腺原氨酸,每次25ml,靜注,每6小時1次,同時用氫化可的松50~100mg靜滴。水中毒者套用氫化可的松100~150mg靜滴。
治療方法
一般治療
患者應加強營養,宜進高蛋白、高能量、富含維生素的食物。平時應注意休息,盡力防止感染,避免精神刺激,避免過度勞累和激動,保持心情愉快,冬季加強保暖。
病因治療
對於病因明確的病人應儘量作病因治療,如垂體及其鄰近部位腫瘤引起者可做腫瘤切除或放射治療。但很多情況下,腺垂體功能減退一經形成就無從作病因治療(如產時或產後大出血以及垂體手術引起的腺垂體功能減退)。
內分泌治療
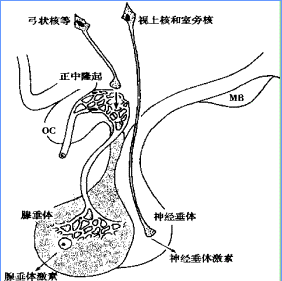 希恩綜合徵
希恩綜合徵 (1)GH不足的治療:兒童期起病者應積極補充GH,具體治療方法同GH缺乏性侏儒症。成年起病者如存在GH不足,是否應補充GH尚無統一意見。不過,晚近的許多資料顯示,補充GH具有改善生活質量,增加骨密度,減輕肥胖等益處。因此,對於經濟條件許可者最好給予GH製劑。
(2)ACTH不足的治療:ACTH不足是通過腎上腺皮質功能減退而表現出來的,且ACTH不能口服,補給不易,故目前一般通過腎上腺皮質激素的替代來糾正ACTH不足引起的症狀。氫化可的松為生理性糖皮質激素,故為首選,12.5~25mg/d,清晨和午後2次服用,清晨劑量宜稍大於午後。也可選用可的松或潑尼松,可的松劑量可同氫化可的松,潑尼松為2.5~5mg/d。潑尼松需在肝臟轉化後才具有活性,故有肝功能受損者不宜使用潑尼松。如存在應激(發熱、感染、創傷等),應加大劑量,氫化可的松可用至200~300mg/d。補充糖皮質激素後,病人的體力和精神面貌可有明顯改善,血壓回升,排泄水負荷的能力增強。用藥劑量過大可出現失眠、精神失常等症狀,應予注意。
(3)TSH不足的治療:同ACTH不足的治療一樣,目前,也是採用甲狀腺激素替代的方法來糾正TSH不足引起的症狀。甲狀腺激素替代治療應從小劑量開始,逐漸增加劑量。如用甲狀腺粉(片),可從20~40mg/d開始,每2周加量1次,每次可增加20mg,直至60~120mg/d,以後一直維持。用藥量可根據季節調整,冬季氣候寒冷,劑量宜稍大,夏季可略小。如用左甲狀腺素鈉,可從50μg/d開始,在數周內增至100~200μg/d;如用碘賽羅寧(T3)可從10~20μg/d開始,在數周內增至50~75μg/d。碘賽羅寧(T3)作用快而短,不適於長期替代治療,故目前一般多用甲狀腺粉(片)或左甲狀腺素鈉。應該注意的是,甲狀腺激素替代治療應在糖皮質激素替代治療的基礎上進行,如單用甲狀腺激素,可因代謝增加而加重糖皮質激素缺乏,甚至誘發危象。但如單用糖皮質激素,也可加重甲狀腺激素缺乏,故應聯合補充2種激素,且糖皮質激素替代應先於甲狀腺激素替代。
(4)LH/FSH不足的治療:LH/FSH不足的治療比較複雜,其治療方案應根據年齡(少年還是成年)、性別、病變部位(下丘腦還是垂體)、有無生育要求而確定。青春期前起病者,無論男女其治療的目標都是讓病人獲得正常的性發育並保持有效的性能力和生育能力。原發性(垂體性)LH/FSH不足者可補充促性腺激素,繼發性(下丘腦性)LH/FSH不足者可補充促性腺激素或GnRH,在病人完成性發育及生育後可改用性激素治療。青春期後起病且有生育要求者,如為原發性LH/FSH不足應補充促性腺激素,如為繼發性LH/FSH不足可給予促性腺激素或GnRH。青春期後起病無生育要求者可給予性激素,男性給予雄激素製劑,年輕女性給予雌激素和孕激素以獲得人工月經周期,老年女性可給予替代性雌激素。子宮完好者應給予孕激素(如甲羥孕酮),以免子宮內膜過度增殖誘發子宮內膜癌。
①GnRH的治療:GnRH亦即LHRH,它於20世紀80年代初開始用於下丘腦性性腺功能減退症的治療,它對垂體病變引起的性腺功能減退症和原發性性腺功能減退症無治療作用。生理狀態下,GnRH呈脈衝性分泌,男性大約每2小時釋放1次,女性大約每90分鐘釋放1次。GnRH這種分泌特性為其生理效應所必需,因為持續給予GnRH將抑制LH/FSH的分泌(失敏現象)。因此臨床上必須以脈衝的方式給藥,這一般是通過GnRH泵輸注的方法實現的。市售GnRH泵的脈衝釋放頻率可以自行調節,一般採用每90分鐘或2小時釋放1次。每個脈衝釋出的藥量以2.5~20μg為宜,少數男性病人可用至40μg。劑量過大可出現失敏現象,從而抑制垂體LH/FSH的分泌,於疾病不利。有少數病人在用藥過程中可產生抗GnRH的抗體,抗體的出現將顯著降低療效。GnRH脈衝式泵輸注的療效是肯定的。在女性,其誘導排卵的成功率達90%,同促性腺激素治療相比,其引起多胎妊娠及卵巢過度刺激的機會大大減小,但其對合併有高雄激素的婦女療效較差。在男性,GnRH治療可使80%~95%的病人出現正常的性發育。同促性腺激素治療相比,GnRH治療能更快、更有效地促進睪丸的發育及生精作用。GnRH治療能使50%~75%的病人精子數目達到正常水平。GnRH治療在恢復精子的活力及形態方面則更為有效,因此,即使是治療後精子數目未達到正常水平的病人仍有可能生育。在某些女性病人,雌激素拮抗藥氯米芬也可誘發排卵。氯米芬能同雌激素受體結合而阻斷雌激素對GnRH的負反饋抑制,使GnRH分泌增加,從而誘導排卵。但氯米芬由於有抗雌激素的副作用,目前已較少使用。
②促性腺激素治療:主要的促性腺激素製劑有垂體源促性腺激素、重組FSH(recFSH。)、重組LH(recLH)、絨促性素(人絨毛膜促性腺激素)及尿促性素(人絕經後促性腺激素)。垂體源促性腺激素含有LH和FSH但來源有限,無實用價值,recFSH和recLH尚未推廣套用,目前常用的為絨促性素(HCG)和尿促性素(HMG)。絨促性素(HCG)的作用與LH相似,在女性促進排卵,在男性促進雄激素的合成;尿促性素(HMG)亦稱促月經素(menotropin),既含有LH也含有FSH,但以FSH為主,在女性主要促進卵泡成熟,在男性主要促進生精。促性腺激素治療的對象主要為那些希望生育的病人。對女性病人來說,一般先給予尿促性素(HMG)使卵泡發育,待卵泡成熟後再用絨促性素(HCG)促發排卵。尿促性素(HMG)治療目前提倡低劑量方案,可從75U/d開始,連續使用7~14天,如無卵泡成熟可將劑量加半(112.5U/d),再用7~14天,如還沒有排卵,可再增加起始量的一半(150U/d),直至有卵泡成熟。目前,一般採用B型超聲和監測血雌二醇濃度的方法來判斷是否有卵泡成熟,卵泡直徑達到17mm(B型超聲測定)或血雌二醇升至1098pmol/L(300pg/ml)以上為卵泡成熟的標誌。有時雖無卵泡成熟但小卵泡較多,血雌二醇濃度仍可明顯升高,因此,在判斷卵泡是否成熟時卵泡直徑較血雌二醇濃度更為可靠。在肯定有卵泡成熟後,應立即肌內注射絨促性素(HCG)1~2天,5000~10000U/d,以誘發排卵。如果有多個卵泡同時成熟或接近成熟的卵泡過多,則不應給予絨促性素(HCG)以誘發排卵。排卵後可注射尿促性素(HMG)2000U2~3次或絨促性素(HCG)5000U1次以維持黃體的功能,也可陰道內給予微粒化的孕酮200~300mg/d。少數所謂“低反應者”需要較大量的促性腺激素製劑,對這些病人可聯合套用GH,因為GH及其刺激產物IGF-I能增加卵巢對LH和FSH的反應。
上述治療能使近90%的病人受孕(部分合併高雄激素血症的病人療效較差),但流產的發生率和胎兒的圍生期死亡率較高。治療的主要副作用為過度刺激綜合徵(hyperstimulationsyndrome)和多胎妊娠。過度刺激綜合徵為卵巢受FSH過度刺激所致,在治療過程中的發生率約4%,其主要表現有:體重增加(超過3kg),腹痛,卵巢腫大、觸痛。多胎妊娠的發生率20%~30%。男性病人亦可用促性腺激素製劑治療,一般先單用絨促性素(HCG)(1500~2500U/次,每周2~3次,歷時4~6周)使病人的睪丸充分發育,待血睪酮達正常水平後加用尿促性素(HMG)(75~300U/次,每周3次)以促進精子的產生。絨促性素(HCG)和尿促性素(HMG)的劑量個體差異很大,應根據病人的具體情況調整劑量。絕大多數病人治療後能獲得正常的性功能和生育能力。
總之,絨促性素/尿促性素(HCG/HMG)治療的效果是肯定的,且其對下丘腦性促性腺激素不足和垂體性促性腺激素不足具有同樣的效果。有學者指出,recLH和recFSH較絨促性素(HCG),尿促性素(HMG)更好,將來可能取代絨促性素(HCG)和尿促性素(HMG)。③性激素治療:對於沒有生育要求的病人,可不給予GnRH或促性腺激素製劑,而直接補給性激素以改善因性激素缺乏引起的症狀。男性病人的性激素治療:睪酮為最重要的生理性雄激素,性腺功能減退者每天需睪酮5~10mg,但睪酮口服後絕大部分在肝臟代謝成無活性或活性很低的產物,故口服睪酮難以達到有效的血藥濃度。其他天然雄激素亦是如此。
雄激素製劑多為人工合成的睪酮衍生物,可分為3類:第1類為睪酮17α位烷化後的產物,如美雄酮(去氫甲睪酮)、甲睪酮等;第2類為睪酮酯類,即睪酮17β羥基酯化後的產物,主要有丙酸睪酮、醋酸西美諾龍(methenoloneacetate)、十一酸睪酮等;第3類為睪酮A,B,C環修飾後的產物,如氟甲睪酮、19-去甲睪酮(19-nortestosterone)等。烷基化睪酮衍生物吸收快,在肝內降解慢,故能達到有效的血藥濃度,但其烷基對肝細胞損害較大,故目前已很少使用。睪酮酯類為脂溶性,水解為睪酮後發揮作用。大多數睪酮酯類不能口服,但醋酸美雄酮(甲基雄烯醇酮)和十一酸睪酮可口服,前者經腸道淋巴系統直接體循環,後者因有甲基使肝臟對其滅活作用減弱故能維持有效血藥濃度。環修飾睪酮衍生物作用強大,但也有損肝作用。目前,使用最多的為睪酮酯類。長效睪酮酯類(如庚酸睪酮)可2~4周肌注1次,200~250mg/次;短效製劑如丙酸睪酮需每2~3天肌注1次,25~50mg/次。十一酸睪酮可口服,劑量為80~160mg/d,該藥半衰期短,故每天藥量應分2~3次口服。十一酸睪酮已有微粒化製劑,每天給藥1次即可。睪酮酯類治療可使病人維持第二性徵和性功能。對於青春期前患者,也可使用雄激素以誘導青春期性發育,一般從12~14歲開始,起始劑量宜較小,以後緩慢加量。如選用睪酮酯類,可每月每平方米體表面積增加50~100mg。雄激素製劑只能誘導和維持第二性徵,生精作用甚弱,故對青春期前患者宜給予GnRH或促性腺激素製劑,雄激素製劑可作為輔助藥物。睪酮貼片亦已問世,貼片裡的睪酮可經皮吸收而避免肝臟的首過滅活。睪酮貼片提供的為生理性雄激素,副作用較少。雄激素治療常見的副作用有:體重增加、血紅蛋白增高、痤瘡、前列腺癌(老年男性)、鈉瀦留。雄激素製劑在外周可被轉變成雌激素,故有些病人(特別是肝功能不佳者)在治療過程中出現女性化症狀,最常見的女性化症狀為男性乳房發育。青春期前患者如雄激素劑量過大可致骨骺閉合過早,其成年身高將受影響。烷基化睪酮衍生物還可引起血脂異常(HDL-Ch降低,LDL-Ch升高)並損害肝功能,嚴重者可致紫癜性肝病(purpurichepatis)。女性病人的性激素治療:沒有生育要求的女性病人可僅給予性激素治療,有生育要求者應以GnRH或絨促性素/尿促性素(HCG/HMG)治療為主,但性激素治療亦可作為輔助手段。
病人的年齡對選擇治療模式很重要:對育齡婦女應予周期序貫治療;對絕經後女性則可僅給予雌激素或雌、孕激素持續性聯合套用。單純雌激素療法:可有效地改善雌激素不足的症狀如血管舒縮功能紊亂、失眠、緊張焦慮、記憶力下降、注意力不集中、萎縮性陰道炎、陰道黏膜萎縮性出血、性慾降低、性感缺失、性交困難等,並能預防骨質疏鬆、降低心血管疾病的危險性。但單用雌激素不能造成月經,對女性的心理健康不利,故50歲以下的婦女一般不採用此種治療方法。生理性雌激素製劑如雌二醇、雌三醇口服後大部分在肝臟滅活,故目前多採用其微粒化製劑或貼片。戊酸雌二醇及結合雌激素(conjugatedestrogen)口服有效,其劑量分別為1~2mg/d,0.3~0.625mg/d。周期序貫療法:每月用雌激素25天,在用藥的後10天加用孕激素,停藥後出現子宮內膜出血,即所謂人工月經。常用的孕激素及其劑量如下:甲羥孕酮(安宮黃體酮)5~10mg/d,二甲脫氫孕酮(medrogestone)5mg/d,脫氫逆孕酮(dydrogesterone)10~20mg/d,醋酸氯羥甲烯孕酮(cyprogesteroneacetate,CPA)1mg/d,微粒化孕酮200~300mg/d,去氧孕烯(地索高諾酮)0.15mg/d,醋酸炔諾酮(norethisteroneacetate,NEPA)1mg/d,炔諾孕酮(norgestrel,NORG)0.15mg/d。雌、孕激素持續性聯合療法:雌激素用量同上,孕激素為上述劑量的1/3~1/2,不停藥,此法無子宮內膜出血。雌激素可使子宮內膜癌和乳癌發病率增加;孕激素不增加乳癌發病率,而且可有效地對抗雌激素誘發子宮內膜癌的作用。
研究表明,接受周期序貫療法和雌、孕激素持續性聯合療法的病人子宮內膜癌的發病率並無增加,因此目前認為,只要病人有子宮就應同時給予孕激素。由於性激素補充治療能有效地降低心血管疾病的發病率和死亡率,並可減少發生骨質疏鬆的機會,因此,從整體的角度來說,這種治療對病人利大於弊。實際上,長期治療可使病人的預期壽命增加2~3歲。更重要的是,治療可大大提高病人的生活質量。
危象治療
(1)針對誘因的預防和治療措施:避免受寒、飢餓、外傷、感染。如因某種原因出現嘔吐、腹瀉、脫水,應立即給予相應處理。病人如需手術,應做好術前準備,麻醉時更應小心,藥物劑量宜小,麻醉或術中出現問題應立即處理。有感染者,積極抗感染。
(2)糾正低血糖:一般先靜脈注射50%葡萄糖溶液40~60ml,繼以10%葡萄糖溶液或5%葡萄糖生理鹽水靜脈滴注。應同時給予糖皮質激素,這也有助於糾正低血糖。由於病人體內升糖激素總是不足的,故即使血糖不低也應補充葡萄糖。
(3)補充糖皮質激素:危象病人糖皮質激素的缺乏多很嚴重,故應積極補充。一般採用生理性製劑氫化可的松(皮質醇),可在10%葡萄糖溶液500ml中加入氫化可的松(皮質醇)100mg靜脈滴注,首日用量200~300mg。如為水中毒型宜先靜脈推注氫化可的松25mg(溶於25%葡萄糖溶液40ml中),繼以上述劑量靜脈滴注。如無感染等嚴重應激存在,且體溫低,可減小用量,因為此類病人如氫化可的松用量過大可加重甲狀腺激素的缺乏,從而使昏迷加重。
(4)補充血容量:循環衰竭型垂體危象病人失液、失鹽嚴重,應儘快補足血容量。可靜脈滴注5%葡萄糖生理鹽水,補液量及NaCl用量視失液、失鹽程度及心功能而定。
(5)保暖:低體溫型垂體危象應加強保暖。此型多有較嚴重的甲狀腺激素缺乏,宜補充甲狀腺激素。碘塞羅寧(三碘甲腺原氨酸)作用快,為首選,每6小時靜脈注射25μg;如無針劑,可每6小時口服20~30μg。不能口服者(如昏迷病人)則鼻飼給藥。如無碘塞羅寧(T3),T4或甲狀腺粉(片)亦可。T4的用法為每6小時給25~75μg,甲狀腺粉(片)的用法為每6小時給30~45mg。在補充甲狀腺激素的同時應給予適量的氫化可的松,但其劑量不宜過大。體溫不低者,也可給予小量甲狀腺激素。體溫升高者一般不用甲狀腺激素。
注意事項可疑垂體危象病例,禁用或慎用嗎啡等麻醉劑、巴比妥安眠藥、氯丙嗪等中樞神經抑制劑及各種降血糖藥物,以防止誘發昏迷。對精神失常或神志不清者,應加強安全防範護理,防止發生意外。提供合理飲食,保障營養。預防對某些原因引起的腺垂體功能減退症可通過加強預防措施而免於發病,如提高孕婦的保健水平可減少產後垂體壞死引起的腺垂體功能減退症;提高腦外科及放射治療的水平有助於減少這些因素引起的腺垂體功能減退症。
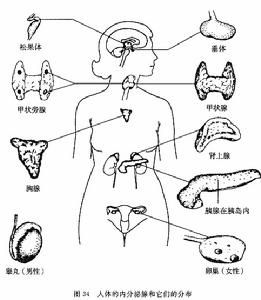
內分泌系統及其疾病
| 內分泌系統(endocrine system)是機體的重要調節系統,它與神經系統相輔相成,共同調節機體的生長發育和各種代謝,維持內環境的穩定,並影響行為和控制生殖等。 |