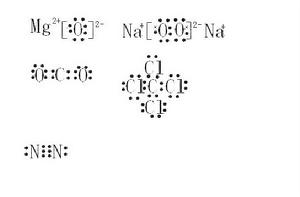使用範圍
用電子式可以表示原子、離子、單質分子,也可表示共價化合物、離子化合物及其形成過程。
原子
依據元素的原子最外層電子個數的多少,先用小黑點“·”(或“×”)等符號在元素符號上、下、左、右各表示出1個電子,多餘的電子配對。
單質分子
必須正確地表示出共用電子對數,並滿足每個原子的穩定結構。
離子
陽離子
簡單陽離子由於在形成過程中已失去最外層電子,所以其電子式書寫方式就是其離子符號本身。例如:Na, K, Mg,Ca,Ba,Al。
複雜的陽離子(例如NH、HO等) 除應標出共用電子對、非共用電子對等外,還應加中括弧,並在括弧的右上方標出離子所帶的電荷。
1.陽離子
2.簡單陽離子由於在形成過程中已失去最外層電子,所以其電子式書寫方式就是其離子符號本身。例如:Na, K, Mg,Ca,Ba,Al。
3.複雜的陽離子(例如NH、HO等) 除應標出共用電子對、非共用電子對等外,還應加中括弧,並在括弧的右上方標出離子所帶的電荷。
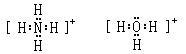 離子的書寫表示
離子的書寫表示 離子化合物
離子鍵的概念為陰、陽離子通過靜電作用形成的化學鍵。以離子鍵結合的化合物叫離子化合物。
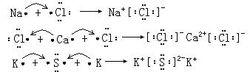 電子式
電子式  電子式
電子式 共價化合物
共價鍵的概念
 電子式
電子式 為原子間通過共用電子對而形成的化學鍵。由共價鍵形成的化合物是共價化合物。共價化合物中原子間全部是共價鍵。
 共價化合物電子式的書寫
共價化合物電子式的書寫 共價化合物電子式的書寫,基本與共價型單質分子相同,一般為正價者在前。對於不同價態的元素的原子,一般將化合價絕對值大的寫在中間,絕對值小的寫在周邊。例如:
離子化合物
離子化合物電子式是將組成的陰陽離子拼在一起進行標示的。書寫規則口訣:多在外、少在內、小在外、大在內、陰陽相間。
多在外、少在內:同種離子數量多的放在離子式的最外側,相對少一些的放在內側書寫。
小在外、大在內:對於不同價態的離子,也按其絕對值,遵照“大值在中間、小值在周邊”的原則書寫。
陰陽相間:書寫時,要做到陰陽離子相間書寫。
對於一種離子數明顯多於其他離子的時候,也可以加角標表示,但較為少見。
1.多在外、少在內:同種離子數量多的放在離子式的最外側,相對少一些的放在內側書寫。
2.小在外、大在內:對於不同價態的離子,也按其絕對值,遵照“大值在中間、小值在周邊”的原則書寫。
3.陰陽相間:書寫時,要做到陰陽離子相間書寫。
4.對於一種離子數明顯多於其他離子的時候,也可以加角標表示,但較為少見。
例如:
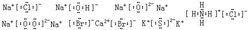 電子式
電子式 注意事項
無論何種微粒,其電子式都是由原子為基本單位組成的,不能出現角碼甚至係數。
組成各種微粒的各個原子的電子式,必須力求均勻、對稱。穩定的8電子結構通常表示為四對電子(一般為元素符號的上、下、左、右各一對電子.)。
中學所學習的經典的8隅體的電子式屬於過時的理論,只能用於表示很少一部分由主族元素形成的物質,不能表示由過渡元素形成的物質。
1.無論何種微粒,其電子式都是由原子為基本單位組成的,不能出現角碼甚至係數。
2.組成各種微粒的各個原子的電子式,必須力求均勻、對稱。穩定的8電子結構通常表示為四對電子(一般為元素符號的上、下、左、右各一對電子.)。
3.過時的理論
局限性
電子式表達物質結構時有一定的局限性,例如;O(兩個三中心π鍵);臭氧(三中心四電子π鍵);超氧化物(三電子π鍵);臭氧化物(三中心五電子π鍵);二氧化碳,一氧化二氮,疊氮根N (三中心四電子π鍵)......等等,都不能用電子式表示其結構。
所以我們才說電子式局限性較大,只能表述一小部分物質的結構。而真正意義上的結構是不能用電子式表示的。
這裡我們需要注意,CO屬於不能用電子式解釋的化合物(存在大派鍵),中學對於CO結構的描述完全錯誤。因為實驗證明,二氧化碳中C-O鍵鍵長介於一氧化碳(典型的三鍵)與羰基(雙鍵)之間,這是電子式所不能解釋的 。下面是對二氧化碳結構的正確描述 :在CO分子中,碳原子採用sp雜化軌道與氧原子成鍵。C原子的兩個sp雜化軌道分別與兩個O原子生成兩個σ鍵。C原子上兩個未參加雜化的p軌道與sp雜化軌道成直角,並且從側面同氧原子的p軌道分別肩並肩地發生重疊,生成兩個∏三中心四電子的離域鍵。因此,縮短了碳—氧原子間地距離,使CO2中碳氧鍵具有一定程度的叄鍵特徵。
CO的正確結構:
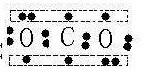 電子式
電子式 電子式的書寫
(1)陰離子和複雜陽離子要加括弧,並註明所帶電荷數,簡單陽離子用元素符號加所帶電荷表示。
(2)要注意化學鍵中原子直接相鄰的事實。
(3)不能漏寫未參與成鍵的電子對。