基本概念
在可逆電池的情況下,整個電池處於電化學平衡狀態,兩個電極也分別處於平衡狀態,電極電位是由能斯特方程決定的,是平衡的電極電位。此時,通過電極的電流為零,即電極反應的速率為零。若要使一個不為零的電流通過電極,電極電位必須偏離平衡電極電位的值,這個現象就稱為電極的極化。
電極極化(electrode polarization) 電子導體與圍岩中溶液接觸時,會形成電偶層,產生電位跳躍,這個電位跳躍便稱為電子導體與溶液接觸時的電極電位。當有外電場作用時,相對平衡的電極電位數值將發生變化。通常把在—定電流密度作用下的電極電位與相對平衡的電極電位的差值,稱為電極極化。常見的有電化學極化、濃差極化等。由電極極化作用引起的電動勢叫做超電壓 。
不可逆條件
在可逆地發生電極反應時電極所具有的電勢,稱為可逆電極電勢。可逆電極電勢對於許多電化學和熱力學問題的解決是十分有用的。但是,在許多實際的電化學過程中,例如進行電解操作或使用化學電池做電功等,並不是在可逆情況下實現的。當有電流通過電極時,發生的必然是不可逆的電極反應,此時的電極電勢 j 與可逆電極電勢 j顯然會有所不同。電極在有電流通過時所表現的電極電勢 j與可逆電極電勢 j產生偏差的現象稱為“電極極化” 。偏差的大小(絕對值)稱為“過電勢”,記作 h ,即:
h=|j-j|
依據熱力學原理可以推知,對於原電池,可逆放電時,兩電極的端電壓最大,為其電動勢E,其值可用可逆電極電勢E表示為:
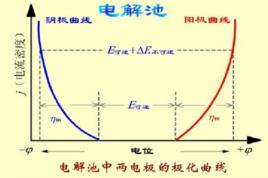
E= j(正極)- j(負極)= j(陰極)- j(陽極)
在不可逆條件下放電時,兩電極的端電壓 E一定小於其電動勢E,即 E= E-△ E。產生偏差的原因是由於電池內阻R所引起的電勢降IR和不可逆條件一兩電極的極化。若通過的電流不是很大,電勢降IR可以忽略不計時,△E的大小可以表示為兩電極過電勢之和,即:
△E= h(陰極)+ h(陽極)
因此:
E=E-DE= j (陰極)- j (陽極)-[ h(陰極)+ h(陽極)]
=( j - h) (陰極)-( j + h)(陽極)
= j (陰極)- j(陽極)
對於電解池,在可逆情況下發生電解反應時所需的外加電壓最小,可稱為“理論分解電壓”,其值與電動勢E相等,可用可逆電極電勢 j 表示為:
E= j(正極)- j(負極)= j(陽極)- j(陰極)
在不可逆情況下發生電解反應時,外加電壓V一定大於電動勢E,即V=E+△V。同理,若通過的電流不是很大,電勢降IR可以忽略不計時,△V的大小亦可以表示為兩電極過電勢之和,即:
DV= h (陽極)- h(陽極)
因此:
V=E-DV
= j (陽極)- j (陰極)+[ h(陽極)+ h(陽極)]
=( j - h) (陽極)-( j - h)(陽極)
= j (陰極)- j(陽極)
綜上所述,無論是原電池還是電解池,相對於可逆電極電勢 j ,當有電流通過電極時,由於電極的極化,陽極電勢升高,而陰極電勢降低,即:
j(陽極) =j+h
j(陰極) =j-h
濃差極化
當有電流通過電極時,因離子擴散的遲緩性而導致電極表面附近離子濃度與本體溶液中不同,從而使電極電勢與 j 發生偏離的現象,稱為“濃差極化”。電極發生濃差極化時,陰極電勢總是變得比 j低,而陽極電勢總是變得比 j高。因濃差極化而造成的電極電勢 j與 j之差的絕對值,稱為“濃差過電勢”。濃差過電勢的大小是電極濃差極化程度的量度。其值取決於電極表面離子濃度與本體溶液中離子濃度差值之大小。因此,凡能影響這一濃差大小的因素,皆能影響濃差過電勢的數值。例如,需要減小濃差過電勢時,可將溶液強烈攪拌或升高溫度,以加快離子的擴散;而需要造成濃差過電勢時,則應避免對於溶液的擾動並保持不太高的溫度。
離子擴散的速率與離子的種類以及離子的濃度密切相關。因此,在同等條件下,不同離子的濃差極化程度不同;同一種離子在不同濃度時的濃差極化程度亦不同。極譜分析就是基於這一原理而建立起來的一種電化學分析方法,可用於對溶液中的多種金屬離子進行定性和定量分析 。
電化學極化
一個電極,在可逆情況下,電極上有一定的帶電程度,建立了相應的電極電勢 j。當有電流通過電極時,若電極一溶液界面處的電極反應進行得不夠快,導致電極帶電程度的改變,也可使電極電勢偏離 j。以電極(Pt)H(g)|H 為例,作為陰極發生還原作用時,由於H 變成H的速率不夠快,則有電流通過時到達陰極的電子不能被及時消耗掉,致使電極比可逆情況下帶有更多的負電,從而使電極電勢變得比 j低,這一較低的電勢能促使反應物活化,即加速H 轉化成H。當(Pt)H(g)|H 作為陽極發生氧化作用時,由於H變成H 的速率不夠快,電極上因有電流通過而缺電子的程度較可逆情況時更為嚴重,致使電極帶有更多的正電,從而電極電勢變得比 j高。這一較高的電勢有利於促進反應物活化,加速使H變為H 。將此推廣到所有電極,可得具有普遍意義的結論:當有電流通過時,由於電化學反應進行的遲緩性造成電極帶電程度與可逆情況時不同,從而導致電極電勢偏離 j的現象,稱為“活化極化”或“電化學極化”。電極發生活化極化時與發生濃差極化時一樣,陰極電勢總是變得比 j低,而陽極電勢總是變得比 j高。因活化極化而造成的電極電勢 j與 j之差的絕對值,稱為“活化過電勢”。活化過電勢的大小是電極活化極化的量度 。
特徵
陰極電位比平衡電位更負(陰極極化)。
陽極電位比平衡電位更正(陽極極化)。
1.陰極電位比平衡電位更負(陰極極化)。
2.陽極電位比平衡電位更正(陽極極化)。