簡介
電化序是按照金屬的化學活潑性次序排列的序列,最活潑的在最上面,活潑性低的“貴金屬”在下面。廣義地說,這樣一個活性序列不限於金屬,也適用於負電性(非金屬)元素。見普通元素的電化序表。
 電化序表
電化序表金屬的電化序最先是在實驗室里通過實驗建立起來的,當時想要決定哪一些金屬能把另外一些金屬從其鹽溶液中置換出來。例如,把一根清潔的鋅條浸入硫酸銅溶液中,很快就發現鋅上有一層沉積的銅覆蓋著,同時鋅呈離子狀態進入溶液。因為鋅能從Cu 離子溶液中置換銅,故按定義鋅比銅活潑。容易看出,這個反應是有電子轉移的氧化-還原反應。
同樣,銅可以從含Ag 離子的溶液中置換銀,使之沉積出金屬銀結晶,溶液呈現出銅離子的顏色。根據剛才得到的結果,活性次序可以排列成Zn,Cu,Ag。將別的金屬一個不漏地進行實驗,就可以列出一個完整的按化學活性次序排列的表,表中最上邊的金屬是最容易給出它們的電子的金屬(也就是電正性最強的元素),電化序表就表示這一排列。作為金屬,鋰表現最高的活潑性。
一個元素的游離原子給出一個電子的難易程度,即通常所說的第一電離勢,是一個精確的物理量,它可以在低壓條件下通過對氣體或蒸氣進行電學實驗而測得。因為決定元素在電化序中次序的置換實驗要涉及到固相和水溶液,以及由此而來的水合作用,所以實驗是在很不相同的條件下進行的。此外,可以預料到溶液中的置換反應將決定於所用試劑的濃度,以及其他可溶性物質的存在與否。
為了得到一個更精確、重複性好的活性序列,最好是藉助於更精確的稱作電極電位或氧化還原勢的物理量,電極電位(或氧化還原勢)的定義為:一個純金屬浸在它的一種鹽溶液中(單位活度,25℃),對浸在具有當量濃度的鹽酸或硫酸中的氫電極所產生的伏特數。
顯然,將實驗條件限制在標準濃度和標準溫度時,水化和濃度的影響就完全保持不變,就可以按金屬的活潑性列出一張更確切的表。因此,任何現存的電化序表一定依賴於氧化勢的測定,並且應該同由這類電化學電池測得的數值相一致。這一相互關係對我們很有用,電化序不再局限於金屬,可以推廣到非金屬或電負性元素。像前邊所說的那樣,能從稀酸(如鹽酸或硫酸)中釋放出氫的那些金屬,在電化序中放在氫的上面;不能從這種稀酸中釋放氫的金屬和非金屬,在電化序中就在氫的下面。對於可逆反應,因為氧化勢和平衡常數有關係,所以在直接進行實驗不方便時就可以由其他數據資料來計算氧化勢,如在鹼金屬鹽類的水溶液中的情況那樣。
標準電極電位和標準電化序
 25℃下水溶液中各種電極的標準電極電位及其溫度係數
25℃下水溶液中各種電極的標準電極電位及其溫度係數從能斯特方程式的推導中,我們已經知道標準電極電位礦是標準狀態下的平衡電位。除了標準氫電極電位被人為規定為零外,其他電極的標準電極電位通常都用氫標電位表示。可以把各種標準電極電位按數值的大小排成一次次序表,這種表稱為標準電化序或標準電位序(如下表列)。表中的電極電位是從負到正排列的,而標準氫電極電位正好處於正、負值交界處。
標準電極電位的正負反映了電極在進行電極反應時,相對於標準氫電極的得失電子的能力。電極電位越負,越容易失電子;電極電位越正,越容易得電子。電極反應和電池反應實質上都是氧化還原反應,因此,標準電化序也反映了某一電極相對於另一電極的氧化還原能力的大小。電極電位負的金屬是較強的還原劑,電極電位正的金屬是較強的氧化劑。
鑒於許多標準電極電位的數值已被精確測定,比較容易從有關資料中查閱到。因此藉助於標準電極電位來分析各種氧化還原反應,可以找到一些解決問題的方法和途徑。所以,標準電化序就成了一種分析氧化還原反應的熱力學可能性的有力工具。
在實際使用中,某些金屬相對於另一些金屬的電極電位的位置變化的另一個原因是因為生成了特殊的表面膜,特別是在氧化性環境時。這種膜層使實測電位向正值(惰性)方向移動,這種情況稱為金屬的鈍化。因此,鉻在電化序中的位置儘管和鋅相仿,但在許多種空氣飽和的溶液中,鉻表面生成一層鈍化膜,它的電化學行為更像是銀。所以,當鉻和鐵耦接時呈陰極,其作用如同一個氧電極而不像鉻電極,所產生的電偶電流加速了鐵的腐蝕。鉻在活化狀態(如在鹽酸中)下,其極性會相反,即鉻對鐵呈陽極。許多金屬,特別是周期表中的過渡金屬,通常都容易在含空氣的溶液中鈍化。因此,利用電化序判別極性時,尤其要注意這種情況。
電化序的套用
1.標準電化序在一定條件下反映了金屬的活潑性
標準電位負的金屬比較容易失去電子,是活潑金屬;而標準電位較正的金屬不易失去電子,是不活潑金屬。 因此根據標準電化序可以粗略判斷金屬發生腐蝕的熱力學可能性。 電位 越負金屬腐蝕的可能性越大。 例如,鋅和鐵的標準電位較負, 它們在空氣中和稀酸中都比較容易被腐蝕。 而銀和金的標準電位較正 , 它們就不容易和稀酸發生反應,也不易在空氣中被腐蝕。
但是應指出,不能單純根據標準電位來估計金屬的耐蝕性。 例如,鋁的標準電位雖然很負但由於鋁表面極易生成一層氧化物膜,故在空氣中比鐵更耐腐蝕。
2.判斷金屬腐蝕
當兩種或兩種以上金屬接觸並有電解液存在時,可根據標準電化序初步估計哪種金屬被加速腐蝕,哪種金屬被保護。 例如,鐵與鎂相接觸,在有電解質溶液存在時就構成了腐蝕電池。 因為鐵的電位較正,成為腐蝕電池的陰極,不會發生腐蝕;而鎂的電位較負,將作為腐蝕電池的陽極而發生腐蝕溶解。
3.標準電化序指出了金屬在水溶液中的置換次序
由於置換反應本質上也是氧化還原反應,所以可以用標準電化序對金屬離子的置換次序作出估計。 在簡單鹽的水溶液中,金屬元素可以置換比它的標準電位更正的金屬離子.
標準電位為負值的金屬可以置換氫離子而析出氫氣,但標準電位為正值的金屬則不能與氫離子發生反應.
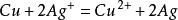 電化序
電化序金屬間的置換反應在電化學生產中常常需要加以防止或利用。 例如,當銅件表而鎖銀時, 若銅件直接浸入電鎖槽,則由於反應, 將在零件表面生成一層疏鬆的結合力很差的“接觸銀”,影響鎖層質量。 所以通常在電鎖前,先將銅件置入浸采液中,通過反應在銅表面生成一層銅采齊,使電極電位變正,電鎖時就可 以避免“接觸銀” 的發生。
4.可以利用標準電化序初步估計電解過程中,溶液里的各種金屬離子(包括氫離子)在陰極析出的先後順序。
電解過程中,在陰極優先析出的金屬離子應是電極電位較正、因而容易得電子的金屬離子。
