疾病分類
 銅代謝障礙
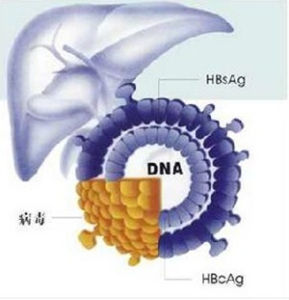
銅代謝障礙銅代謝障礙性疾病,一種是使銅不能合成銅藍蛋白而廣泛沉積在肝、腦、腎、角膜等器官組織中。一種是銅從小腸黏膜細胞運入血液和肝臟中的銅含量減少。根據發病原因的不同,分為wilson病和Menkes氏綜合徵(也稱Menkes病)兩種疾病。
wilson病
簡介
 銅代謝障礙
銅代謝障礙Wilson病即肝豆狀核變性。早自Frerichs(1861)、Westphal(1883)和Strumpel(1898)先後發現一組病例,臨床酷似多發性硬化的表現,而屍檢卻缺乏中樞神經系統特徵性的硬化斑,命名為假性硬化症。1912年Wilson證實青少年發病的假性硬化症,其病理特徵是肝硬化和大腦基底節區的豆狀核變性,命名為進行性肝豆狀核變性。1921年Hall匯集文獻68例進行詳細探討,明確上述兩種疾病實為同一疾病,定名肝豆狀核變性(HLD)或Wilson氏假性硬化症,後人又稱為Wilson病(WD)。據歐美流行病調查統計,本病發病率為0.2/10萬人口,患病率為1/10萬人口,雜合子為1/4000人口。日本資料患病率約1.9~6.8/10萬人口,雜合子高達6.6~13/1000人口。國內雖缺乏本病的流調資料,但安徽中醫學院神經病學研究所附屬醫院1976年10月至2000年10月間收治來自全國各地的HLD患者已近3000例,可見本病在我國並不少見。本病已明確屬常染色體隱性遺傳性銅代謝障礙,造成銅在體內各臟器尤以大腦豆狀核、肝臟、腎臟及角膜大量沉著,而由於銅離子在各臟器沉積的先後不同和數量不一,臨床出現多種多樣的臨床表現,如震顫、扭轉痙攣、精神障礙、肝脾腫大、腹水等。
病因
本病已明確屬常染色體隱性遺傳性銅代謝障礙,造成銅在體內各臟器尤以大腦豆狀核、肝臟、腎臟及角膜大量沉著。
臨床表現
臨床主要表現神經精神症狀與肝臟症狀兩大方面。
1.神經精神症狀
(1)震顫:早期常限於上肢,漸延及全身。多表現為快速、節律性,粗大似撲翼樣的姿位性震顫,可並有運動時加重的意向性震顫。
(2)發音障礙與吞咽困難:多見於兒童期發病的患兒。說話緩慢似吟詩,或音調平坦似念經,或言語斷輟似吶吃;也可含糊不清、暴發性或震顫性語言。吞咽困難多發生於晚期患者。
(3)肌張力改變:大多數患者肌張力呈齒輪樣、鉛管樣增高,往往引致動作遲緩、面部表情減少、寫字困難、步行障礙等。少數舞蹈型患者伴肌張力減退。
(4)癲癇發作:較少見。
(5)精神症狀:早期患者智慧型多無明顯變化,但急性起病的兒童較早發生智力減退;大多數患者具有性格改變,如自制力減退、情緒不穩、易激動等;重症可出現抑鬱、狂躁、幻覺、妄想、衝動等,可引起傷人自傷行為。少數患者以精神症狀為首發症狀,易被誤診為精神分裂症。
2.肝臟症狀
以肝臟症狀為首發症狀有:
(1)通常5~10歲發病。由於肝臟內銅離子沉積達超飽和,引起急性肝衰竭,即腹型肝豆狀核變性。臨床表現為,全身倦怠、嗜睡、食欲不振、噁心嘔吐、腹部膨脹及高度黃疸,病情迅速惡化,多於一周至一月左右死亡,常被誤診為重症病毒性肝炎而按“肝炎”搶救無效死亡,往往在其同胞被確診為本病後,回顧病史時方考慮本病可能。倘若能早期診斷予以確當、強力驅銅和保肝綜合治療,半數以上可獲緩解。
(2)約半數患者在5~10歲內,出現一過性黃疸、短期谷丙轉氨酶增高或/及輕度腹水,不久迅速恢復。數年後當神經症狀出現時,肝臟可輕度腫大或不能捫及,肝功能輕度損害或正常範圍,但B超檢查已有不同程度損害。倘若在神經系統症狀出現前,及時行系統驅銅治療,可長期防止肝臟和腦症狀出現。
(3)少兒期緩慢進行性食欲不振、輕度黃疸、肝臟腫大和腹水,酷似肝硬化的表現。經數月至數年,消化道症狀遷延不愈或日益加重,而漸漸出現震顫、肌僵直等神經症狀。神經症狀一旦出現,肝症狀迅速惡化,多於幾周至2~3月內陷入肝昏迷。因此對原因不明的肝硬化少兒患者,如進行詳細的神經系統檢查,往往能發現肌張力改變或病理反射等中樞神經系統陽性體徵,再進一步行銅代謝檢查,可獲得早期診斷和及時治療。
(4)部分青少年患者可表現緩慢進行性脾臟腫大,並引致貧血、白細胞或(及)血小板減少等脾功能亢進徵象,一般在脾切除或/及門脈分流術後不久,出現神經症狀並迅速惡化,常於短期內死亡;少數患者因食管靜脈破裂致上消化道出血而迅速促發神經症狀。
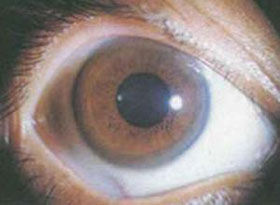
(5)肝症狀發生於其他症狀後:①先出現神經症狀,長期誤診或不規則驅銅治療,神經症狀遷延達晚期,漸發生黃疸、腹水乃至肝昏迷。②以神經症狀獲得正確診斷,體檢時才發現輕度肝脾腫大或/及肝功能異常。③角膜色素環(K-F環)肉眼或裂隙燈在角膜後彈力層周邊部可見棕色、灰色環。
分型
1.潛伏型(亞臨床型)
一般為先證者的一級親屬,在進行銅代謝篩選檢查時發現。
2.顯性型(臨床表現型)
(1)腦型(以神經症狀為核心症狀)
1)廣義肝豆狀核變性型:臨床特徵為:①一般於15歲以前發病;②肌僵直顯著,震顫輕;③晚期呈全身扭轉痙攣。
2)舞蹈-手足徐動型:兒童多見,以臉面不自主扭動和四肢不規則、快速舞動伴肢端緩慢扭動為特徵,少數呈投擲樣運動。
3)假性硬化型:臨床特徵為:①大多於20歲以後起病;②全身震顫較明顯,而肌僵直較輕。
4)精神障礙型:以重精神症狀為首發症狀,神經症狀較輕或缺如,常易誤診為精神分裂症等各種重精神病。
(2)脊髓型或腦脊髓型:此型極少見,脊髓型臨床特徵為:①多見於10~20歲男性患者;②對稱性痙攣性截癱為主要表現。如伴有意識不清、言語錯亂和震顫等腦症狀,稱腦脊髓型。
(3)骨-肌型:臨床特徵為:①大多於17~18歲左右發病;②明顯骨關節症狀及四肢近端肌無力、肌萎縮;③神經症狀和肝症狀較輕或缺如;④病情發展緩慢,預後較良好。
(4)腹型:臨床特徵為:①5~10歲前常以發熱、嚴重黃疸、中度腹水突然起病;②進展迅速,往往在一周至一月內死亡;③生前無錐體外系症狀。
(5)腦-內臟混合型:本組以肝型最多見,臨床表現多樣,主要有下列特徵:①青少年發生緩慢進行性脾腫大,酷似門脈高壓症;②兒童期發生原因不明的進行性肝硬化。如晚期出現神經症狀,稱腦-肝型。另一部分腦型患者,不恰當或不規則治療而達晚期,常並有肝硬化等肝症狀,亦屬腦-肝型範疇。此外,以浮腫、蛋白尿、血尿為主證者,稱腎型;以明顯腦症狀並心臟症狀為主證者稱腦-心型。
診斷
肝豆狀核變性診斷標準:
1.家族遺傳史:父母是近親婚配、同胞有HLD患者或死於原因不明的肝病者。
2.緩慢進行性震顫、肌僵直、構語障礙等錐體外系症狀、體徵或/及肝症狀。
3.肉眼或裂隙燈證實有K-F環。
4.血清銅藍蛋白<200mg/L或銅氧化酶<0.2OD。
5.尿銅>1.6μmol/24h。
6.肝銅>250μg/g(乾重)。
判斷:①凡完全具備上述1~3項或2及4項者,可確診為臨床顯性型。②僅具有上述3~5項或3~4項者屬無症狀型HLD。③僅有1、2項或1、3項者,應懷疑本病。
鑑別
1.肝型HLD
需與慢性活動性肝炎、慢性膽汁淤滯綜合徵或門脈性肝硬變等肝病鑑別。但肝病無血清銅減低、尿銅增高、血清銅藍蛋白和銅氧化酶顯著降低等銅代謝異常;亦無角膜K-F環。
2.假性硬化型HLD
需與帕金森病鑑別,肝豆狀核變性型HLD需與特發性肌張力障礙鑑別。但帕金森病、特發性肌張力障礙均無銅代謝異常及角膜K-F環,可與HLD區別。
治療
 銅代謝障礙
銅代謝障礙1.藥物治療
(1)二巰基丙醇(BAL):BAL是含雙巰基的化合物,水溶液不穩定,故配成10%油劑溶液,僅供肌內注射。優點:BAL的優點是價格低廉,經濟負擔小。缺點是:①副反應多,如臀部膿腫、肝功能損害等使患者被迫停止治療;②長期連續套用,排銅作用逐漸衰減。故目前BAL已趨向淘汰。
(2)二巰丁二酸(DMSA)和二巰丁二酸鈉(Na-DMS):Na-DMS靜注後,血濃度迅速達高峰,4小時排泄80%,無蓄積作用。優點為:①Na-DMS排銅量較高,不僅尿排銅量較治療前平均增高7.7±1.4μmol/24h,且膽汁排銅平均增加1.5倍;②DMSA除輕度胃腸反應及出血傾向外,副反應較少,可作為長期維持用藥。缺點為:Na-DMS出血傾向較重,易引致嚴重鼻衄及皮膚紫癜,偶見上消化道出血。約55%患者治療早期發生短暫腦症狀加重。
(3)二巰丙磺酸鈉(DMPS):DMPS對重金屬解毒作用與BAL相似,但毒性較BAL低約20倍,排銅效果遠強於BAL。優點為:在各種排銅藥物中,尿排銅量最高,副反應少。缺點為:偶見粒細胞缺乏症。
(4)D-青黴胺(PCA):PCA化學名為β,β-二甲半胱氨酸(β,β-dimethylcysteine),它是青黴素的水解產物,臨床主要套用右鏇青黴胺和正-乙醯消鏇青黴胺。優點為:尿排銅增加達24.4μmol/24h,僅次於DMPS,而強於BAL、Na-DMS、DMSA及鋅製劑等。缺點為:①副反應多,早期易發生過敏反應和白細胞減少,長期服藥可發生SLE(系統性紅斑狼瘡)、MG(巨球蛋白血症)、穿通性匐行彈性組織變性、粒細胞缺乏症及再生障礙性貧血等嚴重副反應;②長期服用,排銅作用逐漸衰減。因此,儘管國內外仍將PCA作為HLD的首選和常規治療,但由於多種副反應,使需要終身服用排銅的HLD,往往被迫停藥。
(5)依地酸二鈉鈣(CaNa2EDTA):口服吸收差,臨床常採用肌內或靜脈注射,於注射後1小時左右均勻地分布全身細胞外液,但不能進入紅細胞內,藥物屬水溶性,故不易透過血-腦屏障,腦內濃度極低。優點為:價格低廉,副反應小,尿排銅高於BAL。缺點為:①因與鋅、鐵絡合遠高於銅,並難以通過血腦屏障等點,臨床療效甚微;②連續使用,尿排銅作用漸減弱;③長期大劑量套用,可引起腎臟損害;④排鋅、鐵遠高於排銅,故易引起EDTA過度絡合綜合徵。由於臨床療效極微,目前已較少單用EDTA治療HLD。
(6)三乙烯羥化四甲胺(TETA):TETA是一種多胺類金屬絡合劑,1982年美國食品與藥物管理局(FDA)指定為對不能耐受PCA的HLD患者的治療藥物。本品極易吸收,迄今尚無有關TETA在體內代謝的研究報導。有人認為TETA在體內可能通過與球蛋白競爭和銅絡合,使尿排銅增加。優點為:TETA排銅效果較高。缺點為:價格昂貴,可能致腎臟損害、EPS等嚴重副反應。
(7)鋅製劑:多數學者證明,食物中的鋅抑制銅的吸收,血液中銅和鋅的含量呈負相關,血漿鋅濃度增高,銅含量相應減少。
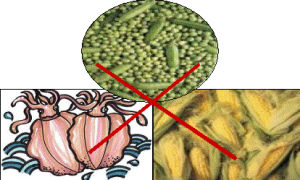
2.低銅飲食
減少食物中銅的攝食為治療的重要組成部分:
(1)含銅量高,禁止攝食的食物:肥豬肉、動物內臟(豬肝、牛肝)、小牛肉等肉類;蟹、蝦、烏賊、章魚、貝介類等魚貝類;黃豆、青豆、黑豆、扁豆、熟葷豆等豆類;花生、芝麻、胡桃等堅果類。此外,蘑菇、牡蠣、蜈蚣、全蠍等含銅量也高。
(2)含銅量較高,儘量少食的食物:小牛肉、雞蛋、菠菜、香菜、芥菜、蔥、茄子、蜂蜜、芋頭等。
(3)含銅量低,適宜日常吃的食物:精白米麵、蘿蔔、藕、苤藍、芹菜、小白菜、瘦豬肉、瘦雞鴨(去皮去油)、馬鈴薯等。牛奶不僅含銅量低,長期服用有輕度排銅之效。
預後
本病除少數患兒出現酷似暴發性肝的臨床表現,於短期內死亡外,其自然病程大多呈緩慢進行性經過,於起病後4~5年死於肝功能衰竭,或陷入植物人狀態,死於肺炎等併發症。能生存10年以上者,極少見,故預後不良。但在驅銅療法進步的今天,絕大部分早-中期患者通過系統的中西醫結合治療,往往能獲得與正常健康人相似的工作、學習和壽命。
Menkes病
疾病概述
又稱Menkes氏稔毛綜合徵、毛髮灰質營養不良等。
病因病理
病因未明。為性連隱性遺傳。是由於銅在腸膜吸收後,從黏膜細胞向血液轉動過程障礙,使體內銅酶(如賴氨酸氧化酶、酷氨酸酶等)活性降低,引起機體發育和功能障礙。
臨床表現
 銅代謝障礙
銅代謝障礙特徵為生長障礙、精神運動發育障礙、痙攣發作、各種毛髮異常等。
家族中多見於男性,一般生後1~5個月內正常。起病後由於哺乳不良,體重、身長和頭圍均停止發育,有肌陣攣等痙攣發作,智力發育顯著延遲。開始能抬頭能笑,但不久均消失,呈植物狀態,平均19個月死亡。自發運動減少,肌張力降低或增高,腱反射亢進和四肢輕癱等錐體束征,有時視力障礙和視神經萎縮,多數體溫低。毛髮呈連珠毛(結節性,細突交替出現)、捻轉毛(毛髮捻轉,膨隆部和狹窄部重複交織)、結節性裂毛(灰白色小結節,該部呈縱行的細小分斷,狀如毛刷)等,易折斷,因此毛髮稀疏短硬,毛髮和皮膚色澤變白。面部呈下頜小、口蓋高、頰下陷、眉毛平直、弓形上口唇等特點。腦血管造影可見特殊的動脈迂迴,內腔不整齊以及閉塞。
鑑別診斷
(一)Leigh氏綜合徵:多在1~2歲起病,起病緩慢。發育不良,智慧型障礙,共濟失調,無力,肌張力降低,常有痙攣發作,可有斜視、眼震等,後期出現呼吸障礙和球麻痹。毛髮正常,無特殊面貌。腦電圖見瀰漫性慢波和發作性波。血乳酸和丙酮酸增高。
(二)腦性癱cerellarpalsy