引言
細胞同步化(synchronization)是指在自然過程中發生或經人為處理造成的細胞周期同步化,前者稱自然同步化,後者稱為人工同步化。
自然同步化
1.多核體
如粘菌只進行核分裂,而不發生胞質分裂,形成多核體。數量眾多的核處於同一細胞質中,進行同步化分裂,使細胞核達108,體積達5~6cm。瘧原蟲也具有類似的情況。
2.某些水生動物的受精卵
如海膽卵可以同時授精,最初的3次細胞分裂是同步的,再如大量海參卵受精後,前9次細胞分裂都是同步化進行的。
3.增殖抑制解除後的同步分裂
如真菌的休眠孢子移入適宜環境後,它們一起發芽,同步分裂。
人工同步化
1.選擇同步化
1)有絲分裂選擇法:使單層培養的細胞處於對數增殖期,此時分裂活躍,MI高。有絲分裂細胞變圓隆起,與培養皿的附著性低,此時輕輕振盪,M期細胞脫離器壁,懸浮於培養液中,收集培養液,再加入新鮮培養液,依法繼續收集,則可獲得一定數量的中期細胞。其優點是,操作簡單,同步化程度高,細胞不受藥物傷害,缺點是獲得的細胞數量較少。(分裂細胞約占1%~2%)
2)細胞沉降分離法:不同時期的細胞體積不同,而細胞在給定離心場中沉降的速度與其半徑的平方成正比,因此可用離心的方法分離。其優點是可用於任何懸浮培養的細胞,缺點是同步化程度較低。
2.誘導同步化
1)DNA合成陰斷法:選用DNA合成的抑制劑,可逆地抑制DNA合成,而不影響其他時期細胞的運轉,最終可將細胞群阻斷在S期或G/S交界處。5-氟脫氧尿嘧啶、羥基脲、阿糖胞苷、氨甲蝶呤、高濃度ADR、GDR和TDR,均可抑制DNA合成使細胞同步化。其中高濃度TDR對S期細胞的毒性較小,因此常用TDR雙阻斷法誘導細胞同步化:
在細胞處於對數生長期的培養基中加入過量TDR,(Hela,2mol/L;CHO,7.5mol/L)。S期細胞被抑制,其它細胞繼續運轉,最後停在G1/S交界處。
移去TDR。洗滌細胞並加入新鮮培養液、細胞又開始分裂。當釋放時間大於TS時,所有細胞均脫離S期,再次加入過量TDR,細胞繼續運轉至G1/S交界處,被過量TDR抑制而停止。
優點是同步化程度高,適用於任何培養體系。可將幾乎所有的細胞同步化。缺點是產生非均衡生長,個別細胞體積增大。
2)中期阻斷法:利用破壞微管的藥物將細胞阻斷在中期,常用的藥物有秋水仙素和秋水仙醯胺,後者毒性較少。優點是無非均衡生長現象,缺點是可逆性較差。
方法
在一般培養條件下,群體中的細胞處於不同的細胞周期時相之中。為了研究某一時相細胞的代謝、增殖、基因表達或凋亡,常需採取一些方法使細胞處於細胞周期的同一時相,這就是細胞同步化技術。選用DNA合成抑制劑可逆地抑制S期細胞DNA合成而不影響其他細胞周期運轉,最終可將細胞群體阻斷在G1/S期交界處;一些抑制微管聚合的藥物,因抑制有絲分裂裝置的形成和功能行使,可將細胞阻斷在有絲分裂中期,即使細胞同步於M期。細胞同步化實際包括用一定的方法獲得一定數量的同步化細胞群和使細胞進入同步化生長的兩層含義。
(一)M期同步化方法
1.振盪收集法
該法利用M期細胞變圓易脫落的特點,將生長旺盛的貼壁細胞按一定的時間間隔振盪,使M期細胞脫落,逐步收集培養基,並補充新的培養基。收集的細胞放4~E冰櫃中保存,離心沉澱後即獲得M期細胞。
2.秋水仙胺阻抑法
(1)將細胞傳代培養至指數生長期。
(2)加入秋水仙胺,使最終濃度為0.05—0.1μg/mL培養基,作用6—7h。如使用秋水仙素,使用濃度應加大5~10倍。
(3)盪收集細胞,800r/min離心5—10min,棄上清,收集的沉澱細胞即為M期細胞。加入一定量培養基將細胞接種到培養瓶中或直接進行離體實驗。由於秋水仙素或秋水仙胺對細胞有一定毒性,用量較小或作用時間較短細胞活性尚可恢復,而用量過大或時間過長則細胞不能存活,因此使用時應嚴格控制其劑量和作用時間。
3.N2阻斷法此方法較秋水仙胺阻抑法好。
(1)將細胞傳代培養至指數生長期。
(2)將培養瓶置於N20罐中通人適量CO2(約相當於罐中體積的5%)。
(3)關閉好N2罐,接上N2管子及壓力表,緩緩向罐中充氣一直到壓力為80-90磅/英寸2為止。
(4)將N2裝置放在37℃培養箱中10—16h(通常過夜)。次日從培養箱中取出,然後緩緩將N2放出(最好放出窗外)。
(5)取出細胞在鏡下觀察同步化效果,用振盪法收集細胞於離心管中。
(6)800r/min離心10min收集細胞。
(二)S期同步化方法
胸腺嘧啶核苷(TdR)雙阻斷法:該法利用過量TdR能阻礙DNA合成的原理而設計,為了加強細胞同步化效果,常採用兩次TdR阻斷法,即雙阻斷法。第1次阻斷時間相當於G2、M和G1期時間的總和或稍長,釋放時間不短於S期時間,而小於G2+M+G1期時間,這樣才能使所有位於G1/S期的細胞通過S期,而又不使沿周期前進最快的細胞進入下一個S期。第2次阻斷時間同第1次,再釋放。現以HeLa細胞為例加以說明(HeLa細胞周期時間為21h,其中G1期為10h,S期為7h,G2期為3h,M期為1h)。
1.將細胞培養至指數生長期的早期。
2.加入含2mmol/LTdR的培養基(2—2.5mmol/L用於腫瘤細胞的同步化培養,而CHO細胞則用7mmol/LTdR),作用16h。
3.棄掉TdR培養基,用Hanks液洗2—3次,再換上新鮮培養基繼續溫浴9h。
4.重新加入TdR培養基(濃度同上)進行第2次阻斷,作用16h。
5.再棄掉TdR培養基,Hanks液洗2—3次後換上普通培養基。第2次TdR釋放0h時取樣則細胞處於G1/S期交界處;如2-7h取樣則為不同階段的S期細胞。注意:具體TdR作用和釋放的時間應參考每一種待同步化細胞的細胞周期各時相測定的參考值,也可根據經驗確定。
(三)G1期和G2期細胞的獲得
1.G2期細胞的獲得根據細胞周期測定的數值,採用TdR雙阻斷法使細胞同步在G1/S期交界處後,洗去TdR使細胞釋放後繼續培養。其培養時間應大於S期時間而小於S+G2期時間。然後先用振盪法使已進入M期的細胞脫落,棄去上清培養基;再用胰酶消化,加入新鮮培養基製成細胞懸液,離心收集細胞,即為G2期細胞。
2.G1期細胞的獲得
(1)將用M期阻斷法獲得的細胞加入一定量的培養基,繼續培養1-10h即可獲得各階段的G1期細胞。
(2)用缺乏異亮氨酸的培養基培養細胞,培養時間超過一個細胞周期,即可獲得中G1期細胞。
(四)G0期細胞的獲得
可採用血清飢餓法得到G0期細胞:
1.取處於對數生長期的細胞。
2.用含0.5% - 1%小牛血清的培養基培養細胞48-72h。或用無血清的培養基培養24h。
3.用0.1%-0.25%胰蛋白酶消化細胞可收穫G0期細胞,可用’H-TdR摻人進行測量鑑定。
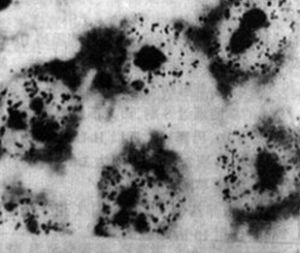
(五)同步化細胞的檢測對各個時期的同步化細胞可通過流式細胞術來鑑定其細胞周期,通過比較各時相細胞的百分比,看是否達到預期的目的。S期細胞可通過放射自顯影來鑑定結果(圖2—3—2),M期細胞可塗片、染色,在顯微鏡下觀察染色體,計有絲分裂指數(圖2—3—3)。
圖2—3—2放射自顯影顯示S期同步化後的HeLa細胞,觀察細胞核內’H—TdR的摻入(彭安,1993)
圖2—3—3秋水仙胺M期同步化後的HeLa細胞,顯示細胞分裂相(彭安)
(六)為了提高同步化效率,也可將幾種同步化方法結合使用。如用N2阻斷法進行M期細胞同步時,可先將對數生長期細胞用2.5mmoL/LTdR處理一段時間,更換新鮮培養基並釋放一段時間後,裝入笑氣罐中,這樣處理可進一步提高M期細胞同步率。