定義介紹
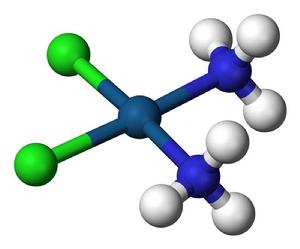
配位化合物為一類具有特徵化學結構的化合物,由中心原子(或離子,統稱中心原子)和圍繞它的分子或離子(稱為配位體/配體)完全或部分通過配位鍵結合而形成。
包含由中心原子或離子與幾個配體分子或離子以配位鍵相結合而形成的複雜分子或離子,通常稱為配位單元。凡是含有配位單元的化合物都稱作配位化合物。研究配合物的化學分支稱為配位化學。
例如,K[Fe(CN)]、[Cu(NH)]SO、[Pt(NH)Cl]和[Ni(CO)]都是配合物。
穩定性介紹
通常,配位化合物的穩定性主要指熱穩定性和配合物在溶液中是否容易電離出其組分(中心原子和配位體)。配位本體在溶液中可以微弱地離解出極少量的中心原子(離子)和配位體,例如〔Cu(NH)〕 可以離解出少量的Cu 和NH:
配位本體在溶液中的離解平衡與弱電解質的電離平衡很相似,也有其離解平衡常數,稱為配合物的穩定常數K。
K越大,配合物越穩定,即在水溶液中離解程度小。
配合物在溶液中的穩定性與中心原子的半徑、電荷及其在周期表中的位置有關,也就是該配合物的離子勢:φ=Z/r φ為離子勢 Z為電荷數 r為半徑。過渡金屬的核電荷高,半徑小,有空的d軌道和自由的d電子,它們容易接受配位體的電子對,又容易將d電子反饋給配位體。因此,它們都能形成穩定的配合物。鹼金屬和鹼土金屬恰好與過渡金屬相反,它們的極化性低,具有惰性氣體結構,形成配合物的能力較差,它們的配合物的穩定性也差。
配合物的穩定性符合軟硬親和理論,即軟親軟、硬親硬。
穩定常數
設ML型配合物在溶液中存在下列平衡,則可用逐級穩定常數(stepwise stability constant) K來表示各級的平衡狀況 :
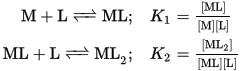 累積穩定常數
累積穩定常數為書寫簡便起見,在配位平衡中常常略去離子的電荷。例如分別以下面的符號表示括弧內的離子:H(H )、OH(OH )、M(Mn )、L(L )、ML((ML) )等。
在實際計算中採用累計穩定常數更為方便。累計穩定常數(cumulative stability constant) β定義為
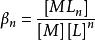 累積穩定常數
累積穩定常數因此
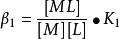 累積穩定常數
累積穩定常數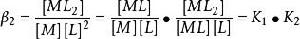 累積穩定常數
累積穩定常數 累積穩定常數
累積穩定常數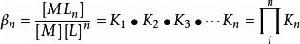 累積穩定常數
累積穩定常數K和 β均為濃度常數,與溫度和離子強度有關。因為這些數值較大,常用指數或對數形式表示,根據 lgβ值,不難求出各級穩定常數 K。
計算示例
已知Zn 和NH的累計穩定常數 lgβ分別為2.27,4.61,7.01和9.06。試求各級穩定常數。
根據β的定義
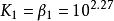 累積穩定常數
累積穩定常數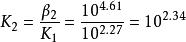 累積穩定常數
累積穩定常數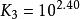 累積穩定常數
累積穩定常數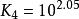 累積穩定常數
累積穩定常數類似的可以計算出 , .
影響因素
金屬離子M 和配位體A 生成配離子MA ,在水溶液中存在如下平衡:
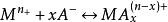 累積穩定常數
累積穩定常數根據平衡移動原理,改變M 或A 的濃度,會使上述平衡發生移動。若在上述溶液中加入某種試劑使M 生成難溶化合物,或者改變M 的氧化狀態,都會使平衡向左移動。若改變溶液的酸度使A 生成難離解的弱酸,也可使平衡向左移動。
配合平衡同樣是一種相對的平衡狀態,它同溶液的PH值、沉澱反應、氧化還原反應等都有密切的關係。
(一)與酸度的關係
根據酸鹼質子理論,所有的配位體都可以看作是一種鹼。因此,在增加溶液中的H 濃度時,由於配位體同H 結合成弱酸面使配合平衡向右移動,配離子平衡遭到破壞,這種現象稱為酸效應,例如:
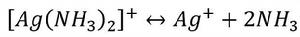 累積穩定常數
累積穩定常數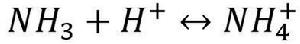 累積穩定常數
累積穩定常數配位體的鹼性愈強,溶液的PH值愈小,配離子愈易被破壞。
金屬離子在水中,都會有不同程度的水解作用。溶液的PH值愈大,愈有利於水解的進行。例如:Fe3+在鹼性介質中容易發生水解反應,溶液的鹼性愈強,水解愈徹底(生成Fe(OH)沉澱)。
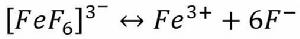 累積穩定常數
累積穩定常數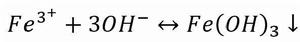 累積穩定常數
累積穩定常數因此,在鹼性介質中,由於Fe 水解成難溶的Fe(OH)沉澱而使平衡向右移動,因而[FeF] 遭到破壞,這種現象稱為金屬離子的水解效應。
(二)與沉澱反應的關係
當向含有氯化銀沉澱的溶液中加入氨水時,沉澱即溶解。
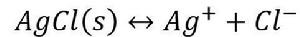 累積穩定常數
累積穩定常數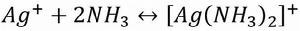 累積穩定常數
累積穩定常數當在上述溶液中加入溴化鈉溶液時,又有淡黃色的沉澱生成。
由於AgBr的溶解度比AgCL的溶解度小得多,因而Br 爭奪Ag 的能力比CL 的大,所以能產生AgBr沉澱而不能產生AgCL沉澱。沉澱劑與金屬離子生成沉澱的溶解度愈小,愈能使配離子破壞而生成沉澱。
(三)與氧化還原反應的關係
配合反應的發生可以改變金屬離子的氧化能力。例如:當PbO與鹽酸反應時,其產物不是PbCL,而是PbCL和CL。但是當它形成[PbCL] 配離子後,Pb就能保持它的+4氧化態。
配合反應影響氧化還原反應的方向。例如,Fe 可以把I 氧化成I:
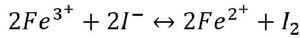 累積穩定常數
累積穩定常數在加入F 後,由於生成[FeF] ,減少了Fe 的濃度,使平衡向左移動。
當我們考查配合反應對氧化還原反應的影響時,不僅要注意配離子的形成,而且還要注意配離子的穩定性。