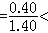矽酸鹽晶體化學
分析矽酸鹽的結構,首先要注意矽氧兩種主要成分。根據鮑林規則的第一規則,矽氧離子半徑比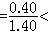 0.414因此Si4+選擇由O2- 所組成的正四面體配位。Si─O鏈長1.6埃,比正、負離子的半徑之和有所縮短,說明鍵有相當程度的極化,Si─O 鍵結合是較強的。根據鮑林第二規則(電價規則),矽-氧鍵的靜電鍵強度為矽離子電價除以配位數=4/4=1,而負離子 O2-的電價數為2。這決定了矽-氧四面體的每一項點 (即O2-)至多只能公用於兩個矽-氧四面體之間,因為兩個 Si-O鍵的鍵強之和等於O2-的電價。按照鮑林第三規則,兩個矽-氧四面體若公用一個邊(即公用兩個頂點)或公用一個面(即公用三個頂點),將使兩個高價Si4+離子距離大大縮短,從而嚴重影響結構的穩定性。這些晶體化學原理決定了矽酸鹽中Si4+必定以強鍵與O2-鍵連線組成矽-氧四面體,每個矽-氧四面體的頂點O2-至多只能為兩個四面體所公用,而兩個矽-氧四面體則難以公用一個以上的頂點。這些原理構成了按矽-氧骨幹的類型對矽酸鹽進行分類的科學基礎。表1列出各種類型的矽-氧骨幹(表中方括弧內為骨幹內矽-氧原子比)。
0.414因此Si4+選擇由O2- 所組成的正四面體配位。Si─O鏈長1.6埃,比正、負離子的半徑之和有所縮短,說明鍵有相當程度的極化,Si─O 鍵結合是較強的。根據鮑林第二規則(電價規則),矽-氧鍵的靜電鍵強度為矽離子電價除以配位數=4/4=1,而負離子 O2-的電價數為2。這決定了矽-氧四面體的每一項點 (即O2-)至多只能公用於兩個矽-氧四面體之間,因為兩個 Si-O鍵的鍵強之和等於O2-的電價。按照鮑林第三規則,兩個矽-氧四面體若公用一個邊(即公用兩個頂點)或公用一個面(即公用三個頂點),將使兩個高價Si4+離子距離大大縮短,從而嚴重影響結構的穩定性。這些晶體化學原理決定了矽酸鹽中Si4+必定以強鍵與O2-鍵連線組成矽-氧四面體,每個矽-氧四面體的頂點O2-至多只能為兩個四面體所公用,而兩個矽-氧四面體則難以公用一個以上的頂點。這些原理構成了按矽-氧骨幹的類型對矽酸鹽進行分類的科學基礎。表1列出各種類型的矽-氧骨幹(表中方括弧內為骨幹內矽-氧原子比)。  矽酸鹽晶體化學
矽酸鹽晶體化學表2內矽(鋁)酸鹽中骨架外的陽離子一般均以離子鍵與矽(鋁)-氧四面體中未公用的頂點O2-相連線,綠柱石中的Al3+與Be2+分別處於O2-所組成的八面體與四面體空隙中,配位數分別為6和4(圖1)。
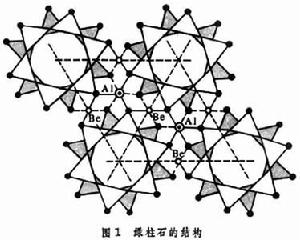 對於未公用的O2-,各與一個Si4+、一個Al3+、一個Be2+鍵接,鍵價之和=4/4+3/6+2/4=2,符合電價規則。值得注意的是矽酸鹽中的氧可以骨幹中的O2-、骨幹外的OH-、H2O等不同形態存在,而Al則既可在骨幹外存在,又能部分取代骨幹中的Si而形成矽鋁酸根,這又進一步增加了矽(鋁)酸鹽結構的複雜性。
對於未公用的O2-,各與一個Si4+、一個Al3+、一個Be2+鍵接,鍵價之和=4/4+3/6+2/4=2,符合電價規則。值得注意的是矽酸鹽中的氧可以骨幹中的O2-、骨幹外的OH-、H2O等不同形態存在,而Al則既可在骨幹外存在,又能部分取代骨幹中的Si而形成矽鋁酸根,這又進一步增加了矽(鋁)酸鹽結構的複雜性。 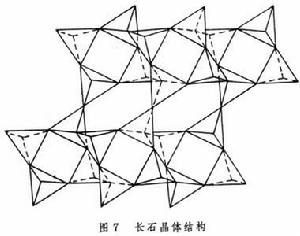 矽酸鹽晶體化學
矽酸鹽晶體化學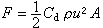
分子篩的主要特色在於它具有孔穴或籠狀結構。矽(鋁)氧四面體通過公用頂點可以形成環或視窗。例如,由六個四面體組成的環可用正六角形表示(角頂為矽,氧則在每個邊的中心附近),成為六元環視窗。在A型分子篩結構圖(圖2)
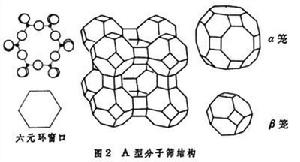 中可看到有四元環、六元環和八元環,八元環視窗,中心處於立方晶胞的面心位置。圖中還可看到由四面體互相連線而組成的籠:在晶胞的每個棱心位置有立方體籠,在晶胞的頂點處則是由四元環和六元環包圍的β籠的中心,在晶胞內部還有一個由四元環、六元環、八元環組成的α 籠(其中心在晶胞體心位置)。
中可看到有四元環、六元環和八元環,八元環視窗,中心處於立方晶胞的面心位置。圖中還可看到由四面體互相連線而組成的籠:在晶胞的每個棱心位置有立方體籠,在晶胞的頂點處則是由四元環和六元環包圍的β籠的中心,在晶胞內部還有一個由四元環、六元環、八元環組成的α 籠(其中心在晶胞體心位置)。 A型分子篩經加熱後可將水分完全脫除,脫水後每克分子篩約有 0.28厘米3的孔穴體積,其內表面積也很大。A型分子篩的有效孔徑隨骨架外的金屬離子而異,當全為Na+時,視窗有效孔徑約為4埃,稱4埃型分子篩。用K+取代Na+,則有效孔徑變小,成為3埃型分子篩。當Na+有約75%被Ca2+取代時,則為5埃型分子篩。經離子交換後,不同孔徑的分子篩有不同的用途,如3埃分子篩可用於丙烯單體的深度脫水,可使水分降至10微克,5埃型分子篩則可用於石油脫蠟以提高油品質量。