簡介
法拉第電解定律Faraday’s law of electrolysis
闡明電和化學反應物質間相互作用定量關係的定律。1833年M.法拉第根據精密實驗測量並提出此定律。內容為:①當電流通過電解質溶液時,在電極(即相界面)上發生化學變化物質B的物質的量與通入的電量成正比 。② 若幾個電解池串聯通入一 定的電量後 ,各個電極上發生化學變化物質B的物質的量相同。特別需要指明 ,在電化學中 B物質的量是以單位電荷離子 電子 (e-)為基本單元 。1摩爾質子的電荷 (即1摩爾電子電荷的絕對值)稱為法拉第常數(F),其數值 F =9.648456×104庫侖/摩爾(C/mol)。若電極反應為:(1)式中各物質的量基本單元分別 、e和M。單位反應速度可理解為Z+摩爾的 和Z+摩爾的e-反 應生成1摩爾的 M。通過溶液的電量(或參與電極反應的電量)Q為:Q=Z++F(2)式(2)中 Z+ 為電極反應式中電子的計量數,公式為法拉第電解定律的數學表達式,它闡明了上述法拉第電解定律的兩條文字敘述。只要電極反應中沒有副反應或次級反應,法拉第電解定律不受溫度、壓力、濃度等條件的限制,是科學準確定律之一。
電解第一定律
在電極上析出(或溶解)的物質的質量m 同通過電解液的總電量Q(即電流強度I與通電時間t的乘積)成正比,即 m=KQ=KIt,其中比例係數K的值同所析出(或溶解)的物質有關,叫做該物質的電化學當量(簡稱電化當量)。電化當量等於通過1庫侖電量時析出(或溶解)物質的質量。
電解第二定律
當通過各電解液的總電量 Q相同時,在電極上析出(或溶解)的物質的質量 m同各物質的化學當量C(即原子量A與原子價Z之比值)成正比。電解第二定律也可表述為:物質的電化學當量K同其化學當量C成正比,即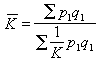
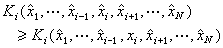
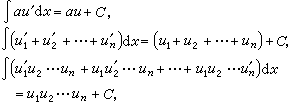
當物質的量為一摩爾時,組成該物質的原子個數等於阿伏伽德羅常數No,其值約為6.022×1023每摩爾。因此,按照法拉第定律,在電極上析出一摩爾物質所需的電量ZF,它等於No個Z價離子所帶電量的絕對值之和。每一Z價離子所帶電量的絕對值等於基本電荷e(電子所帶電量的絕對值,約為1.602×10-19庫侖)的Z倍,由此可見
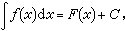
法拉第電解定律是電化學中的重要定律,在電化生產中經常用到它。歷史上,法拉第電解定律曾啟發物理學家形成電荷具有原子性的概念,這對於導致基本電荷e的發現以及建立物質的電結構理論具有重大意義。在R.A.密立根測定電子的電荷e以後,曾根據電解定律的結果計算阿伏伽德羅常數No。