脫鹵氫解
利用催化氫化的脫鹵氫解反應機理如下:鹵代烴通過氫化加成機理與活性金屬催化劑形成有機金屬絡合物,再按催化氫化機理反應得氫解產物。
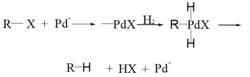 反應機理
反應機理影響因素
鹵代烴的氫解活性由兩方面因素決定,即鹵原子的活性和鹵原子在分子中所處的位置。
1、原子的活性
從取代的鹵原子來看,活性順序為碘>溴>氯>氟。
2、鹵原子在分子中所處的位置
醯鹵、α位有吸電子的基的鹵原子、苄位或烯位鹵原子和芳環上電子云密度較小未位置的鹵原子易發生氫解。因此,酮羰基、氰基、硝基、羧基和磺酸基等官能團的α位鹵原子,均易發生氫解。
套用特點
1、脫鹵氫解的常用辦法
①催化氫化
催化氫化是脫鹵氫解最常用辦法,鈀為首選催化劑,鎳因易受鹵素離子的毒化,一般需增大用量比。氫解後的鹵素離子,特別是氟離子,可使催化劑中毒。在還原過程中,通常用鹼中和生成的鹵化氫,否則氫解反應速率將減慢甚至停滯。例如:
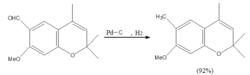 催化氫化
催化氫化②活潑金屬還原
活潑金屬(如鋅粉、合金等)在一定反應條件下,也可發生脫鹵氫解。例如:
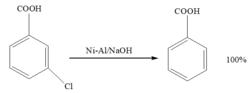 活潑金屬還原
活潑金屬還原③金屬復氫化物還原
氫化鋁鋰、硼氫化鈉等金屬復氫化物,在非質子溶劑中,可用於鹵代烴的氫解。其中,氫化鋁具有更強的還原能力,可用於C–F鍵的氫解。例如:
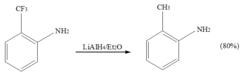 還原反應
還原反應2、反應得選擇性
在不飽和雜環化合物中,相同鹵原子的選擇性氫解與鹵原子的位置有關。如2–羥基–4,7–二氯喹啉(53)的氫解,其分子中有兩個氯原子,因吡啶環氮原子的吸電子作用,使4位電子云密度降低,其相對氫解活性較7位大,故能選擇性氫解4位氯而生成2–羥基–7–氯喹林(54)。
 反應方程式
反應方程式脫苄氫解
苄基或取代苄基與氧、氮或硫連線二成的醇、醚、苄胺、硫醚等,均可通過氫解反應脫去苄基生成相應的烴、醇、酸、胺等化合物,此反應稱為脫苄反應(debenzylation)。其中催化氫化脫苄氫解的反應機理與脫鹵氫解相同。反應通式如下圖:
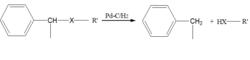 反應通式
反應通式影響因素
在脫苄氫解反應中,底物的化學結構對氫解速率有較大影響。如苄基與氮或氧相連時,脫苄反應得活性因結構不同而有如下圖順序:
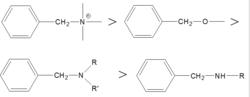 活性順序
活性順序套用特點
脫苄反應可在中性條件下氫解脫保護基,不致引起肽鍵或其他對酸、鹼水解敏感結構的變化,因而在小分子藥物、多肽和天然藥物的合成中得到廣泛套用。如抗病毒藥更昔洛韋(Gancidovir)中間體(56)的製備中,用苄醚結構保護羥基,再經氫解脫苄得中間體,而不影響分子中其他的鍵。
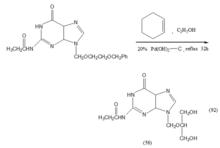 反應過程
反應過程脫硫氫解
硫醇、硫醚、二硫化物、亞碸、碸、含硫雜環化合物等在一定條件下可使鍵斷裂,發生脫硫氫解。
利用催化氫化或化學還原法的脫硫氫解反應機理與脫鹵氫解相同。
影響因素
脫硫氫解可用化學還原法(如金屬復氫化物、辛–乙酸、三苯基膦等)或催化氫化法。其中,催化氫化法常用新製備的含大量氫的活性鎳,鈀和鉑等貴金屬催化劑易受硫化物毒化,一般很少使用。
1、催化氫化法
2位無取代的嘧啶衍生物常用脫硫氫解方法合成。例如:
 催化氫法套用
催化氫法套用2、化學還原法
採用採用化學還原法來還原氫解二硫化合物是製備硫醇最常用的方法。常用鋅–乙酸、金屬復氫化物等還原劑。如化合物(57)在鋅–乙酸作用下,氫解還原得硫巰基苯甲酸(58)。
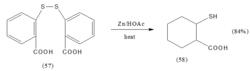 反應方程式
反應方程式套用特點
1、將羰基化合物轉化為烷烴
硫縮酮氫解脫硫是將羰基轉變為亞甲基的常用方法之一,特別是α,β–酮及α雜原子取代酮的選擇性還原,條件溫和、收率較好。如化合物(59)與乙二硫醇反應生成硫縮酮(60),在活性鎳存在下,於乙醇中回流,氫解回流而得烴。
2、硫醇類化合物的製備
二硫化合物可還原氫解為兩分子硫醇,該法是製備硫醇的最常用方法。
