簡介
最簡單的原子光譜,由A.J.埃斯特朗首先從氫放電管中獲得,後來W.哈根斯和H.C.沃格耳等人在拍攝恆星光譜中也發現了氫原子光譜線。到1885年,人們已在可見光和近紫外光譜區發現了氫原子光譜的14條譜線,譜線強度和間隔都沿著短波方向遞減。其中可見光區有 4條, 分別用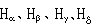 表示。其波長的粗略值分別為6562.8┱、4861.3┱、4340.5┱和4101.7┱。1885年,瑞士物理學家J.J.巴耳末首先把上述光譜用經驗公式:
表示。其波長的粗略值分別為6562.8┱、4861.3┱、4340.5┱和4101.7┱。1885年,瑞士物理學家J.J.巴耳末首先把上述光譜用經驗公式: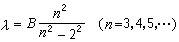
表示出來,式中 B為一常數。這組譜線稱為巴耳末線系。當n→∞時,λ→B,為這個線系的極限,這時鄰近二譜線的波長之差趨於零。下圖是巴耳末線系的示意圖。
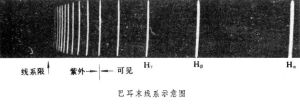 氫原子光譜
氫原子光譜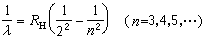
式中
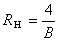 ,稱為里德伯常數,其值為(1.096775854±0.000000083)×10%m-1 。 後來又相繼發現了氫原子的其他譜線系,都可以用類似的公式表示。把波長的倒數稱波數,單位是m-1 ,則氫原子光譜的各譜線系的波數都可用一個普遍公式表示:
,稱為里德伯常數,其值為(1.096775854±0.000000083)×10%m-1 。 後來又相繼發現了氫原子的其他譜線系,都可以用類似的公式表示。把波長的倒數稱波數,單位是m-1 ,則氫原子光譜的各譜線系的波數都可用一個普遍公式表示: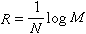
對於一個已知線系,m為一定值,而n為比m大的一系列整數。此式稱為廣義巴耳末公式。氫原子光譜現已命名的6個線系如下:
賴曼系m=1,n=2,3,4,... 紫外區
巴耳末系 m=2,n=3,4,5,... 可見光區
帕邢系m=3,n=4,5,6,... 紅外區
布喇開系 m=4,n=5,6,7,... 近紅外區
芬德系m=5,n=6,7,8,... 遠紅外區
漢弗萊系 m=6,n=7,8,9,... 遠紅外區
在廣義巴耳末公式中,若令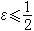 ,為光譜項,則該式可寫成
,為光譜項,則該式可寫成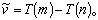 氫原子任一光譜線的波數可表示為兩光譜項之差的規律稱為併合原則,或稱里茲組合原則。
氫原子任一光譜線的波數可表示為兩光譜項之差的規律稱為併合原則,或稱里茲組合原則。
對於核外只有一個電子的類氫離子(如He+ ,Li+2 等)廣義巴耳末公式仍適用,只是核的電量和質量與氫原子核不同,要對里德伯常數R作相應的變動。
當用分辨本領很高的分光儀器去觀察氫原子的各條光譜線時,發現它們又由若干相近的譜線組成,這稱為氫原子光譜線的精細結構。它來源於氫原子能級的細緻分裂。分裂的主要原因是①相對論效應所引起的附加能量ΔEr;② 電子自鏇和軌道相互作用所引起的附加能量ΔEιε 。同時考慮以上兩個因素後,算得氫原子的能級公式為
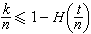
式中h為普朗克常數 с為真空中的光速
с為真空中的光速 R為里德伯常數;n為主量子數
R為里德伯常數;n為主量子數 j為總角動量量子數
j為總角動量量子數 α稱為精細結構常數,其值很小,因此第二項遠小於第一項。如果忽略第二項,上式就是玻爾氫原子理論的氫原子能級公式;若保留第二項,則每一主量子數為n的能級都按不同的總角動量量子數 j表現出了它的精細結構。但這個公式中不含軌道角動量量子數l,而
α稱為精細結構常數,其值很小,因此第二項遠小於第一項。如果忽略第二項,上式就是玻爾氫原子理論的氫原子能級公式;若保留第二項,則每一主量子數為n的能級都按不同的總角動量量子數 j表現出了它的精細結構。但這個公式中不含軌道角動量量子數l,而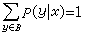 ,這說明按量子力學理論氫原子兩個不同l而n、j相同的能級具有相同的能量,對l是簡併的。精細結構還與原子序數有關,氫能級的精細結構分裂比其他原子(如鈉)的小。早期用高分辨光譜儀器曾觀察到氫的Hα線的部分精細結構,分析後發現與量子力學理論有細小不符之處。
,這說明按量子力學理論氫原子兩個不同l而n、j相同的能級具有相同的能量,對l是簡併的。精細結構還與原子序數有關,氫能級的精細結構分裂比其他原子(如鈉)的小。早期用高分辨光譜儀器曾觀察到氫的Hα線的部分精細結構,分析後發現與量子力學理論有細小不符之處。
1947年 W.E.蘭姆和 R.C.雷瑟福用分子束磁共振法研究氫原子能級的精細結構時測得22 S½比 22 P½高出0.033cm-1 ,現在稱之為蘭姆移位,它很快由量子電動力學得到了解釋。

