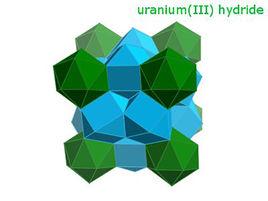
氫化鈾是一種毒性很強,棕灰色到棕黑色引火粉或脆性固體。 其在20℃的密度為10.95g/cm ,遠低於鈾(19.1g/cm )。
結構
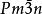 氫化鈾
氫化鈾立方晶系,cP32,空間群 , β型氫化鈾晶格常數a=664.3pm.
氫化鈾存在兩種晶體變體,均為立方晶系:在低溫下獲得的α型和當形成溫度高於250℃時生長的β型。 低溫反應時生成α-UH的亞穩相,其組成為UH,黑色立方晶系晶體,a=416.0pm。在氫氣中直到100℃還很穩定,但在250℃時,2~3h內就會轉變為β-UH。
β-UH為帶有黑或棕色的深灰色結晶,屬立方晶系,計算密度為10.92g/cm,用氦置換法測得其密度為10.95g/cm。具有UH的非整比組成,如,450℃時,H/U=2.976~3.000,650℃時,H/U=2.837~2.929,700℃、5.07×10 kPa時,H/U範圍的下限值大幅度下降,820℃、8.4×10 kPa時,H/U=0.7。在通常的合成條件下,製得的產物都具有近似於UH的組成。離解壓力為:
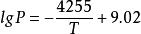 氫化鈾
氫化鈾α和β晶型在低於180K時是鐵磁性,高於180 K時,它們是順磁性的。
氫化鈾不是一個填隙化合物,氫化後金屬晶格擴大,在晶格中每個鈾原子附近有6個鈾原子和12個氫原子,氫占據較大的四面體縫隙。 氫在氫化鈾中的密度大致與液態水或者液氫中相同。 氫化鈾中存在U-H-U氫橋。
性質
氫化鈾具有金屬導電性,微溶於鹽酸和在硝酸中分解 。
氫化鈾反應性很強。細粒UH3在空氣中或氧中於-76℃可自燃;它與水發生劇烈反應,其程度取決於反應物的相對量和接觸速度;與鹵代有機溶劑的反應是危險的,非鹵代有機溶劑不能溶解氫化鈾或不發生反應;與熱濃硫酸反應較快。與強氧化劑接觸會導致火災和爆炸。接觸鹵化碳會劇烈反應。
氫化鈾離子可能會與某些干擾質譜測量,表現為以大眾239的峰值,從而為鈽-239信號的假性增高。
製備
2U+3H=2UH
鈾暴露在氫氣中會導致氫脆,氫氣通過金屬格線擴散形成氫化鈾,氫化鈾與鈾之間存在明顯的邊界。通過真空中加熱退火可以除去氫並恢復延展性。
鈾在氫氣中加熱到250℃到300℃可製得氫化鈾,該反應非常迅速,進一步加熱到500℃可以除去氫。該性質使得從氫化鈾出發可以很方便製得碳化鈾,氮化鈾,鹵化鈾。
用金屬鈾切片與氫氣反應製備UH。除去金屬鈾表面的氧化物,迅速將盛有試樣的石英舟放入反應管中部(氫化物表觀密度為3.4g/cm,若在反覆合成及分解中呈粉末狀時密度降為1.4g/cm以下,所以所用試樣鈾量應取決於石英舟的容量)。將系統抽真空至1×10 Pa(1×10 mmHg)以下,同時用電爐加熱至250℃時,關閉與排氣系統相連線的鏇塞,通入經過淨化裝置淨化的氫氣,使其反應。若取100g鈾切片試樣,則反應約需要30min的時間(關閉系統後,若壓力計所指壓力無變化時,可認為反應結束,塊狀鈾約需2h)。反應結束後,仍使氫壓保持在100kPa,直至冷卻到室溫。這樣製得的三氫化鈾為β型。
鈾與沸水或蒸汽反應也生成氫化鈾。
7U+6HO=3UO+4UH
套用
氫化鈾可用於氫同位素分離,製備鈾金屬粉末,作為還原劑.
氫化鈾在室溫有低的離解壓(約10 Pa),用於氚的貯存就能可靠地保持住氚,而溫度升高到400 ℃ 以上,氫化物又很容易離解釋放出所吸收的氫 。所以,長期以來,氚化鈾被用作氚處理、貯存的最常用、最主要的固體貯氚材料。但是,氫化鈾在實際套用中也存在一些問題,特別是它在氫化過程中容易破碎成細粉 ,這種粉末降低了氫化鈾的熱導性,使溫度難以控制 。同時,鈾吸氫後體脹量很大,這必然增大了鈾床床體的設計體積或減少了鈾床的裝料量。可以通過摻雜鋯等金屬改善吸氫性能。
同時,氘化鈾可以作為中子引發劑 和中子減速劑。
富集到5%的鈾235的氫化鈾可以作為混合核燃料和中子減速劑的主動自調節核反應堆模組。在專利中,可以通過鈾氫化使得氫氣滲透到整體鈾金屬粒中,由於氫化鈾的中子減速作用使得中子減速到允許發生核裂變。鈾235同時作為核燃料。當反應開始之後,反應將持續進行升溫直到大約800攝氏度,氫化鈾分解,由於氫化鈾的減少,中子減速也將減少,因此核反應將趨於停止;當溫度回復到較低水平時,氫氣將再次與金屬鈾化合,緩慢地重新啟動核反應。
歷史
氫化鈾用於一系列實驗來確定鈾的臨界質量。
1943年早期階段的曼哈頓計畫時,氫化鈾和氘化鈾曾被認為是一個有前途的核子彈材料;然而,它被1944年的春天拋棄了,因為結果證明這樣的設計將是低效的。
1953年美國於內華達試驗場進行的一系列核試驗中成功引爆了氫化鈾核子彈。