寄主植物
自然感染櫻桃、大黃、接骨木、美洲榆、美洲山茱萸(H.E.Wat一erworth&R·Lawson,私人通信)和黑刺莓。Schmelzer(1966)把一種接骨木分離株接種於23科雙子葉的 61種植物和一種單子葉植物Commelina coelestris。 Hansen和 stace一Smith報導,其它接骨木分離株侵染55種草木植物中的44種植物。
診斷寄主
覓色黎和茴藜(Chenopodium amaranticolor 和C.quioa), 初級的褪綠和壞死斑;系統斑駁、畸變和壞死。
 櫻桃卷葉病毒
櫻桃卷葉病毒黃瓜(Cucumis sativus),子葉出現初級褪綠斑。冬季在溫室內培育的植株,真葉發生畸變和斑駁,植株矮縮和過早死亡;夏季出現褪綠環和紋,不太影響生長。
菸草(Nicotiana tabacum)White Budey品種,感染2~3天后出現初級的壞死斑點;在一定條件下形成密集的壞死環。系統的壞死和褪綠的環和紋斑;後來長出的葉片無症狀。
黃花煙(N. rustica),初級的褪綠和壞死的斑點和環;系統壞死和褪綠環。
菜豆(Phaseolus vulgaris)的The Prince品種。初期葉片上出現初級的壞死斑;棕色斑點和環;真葉葉脈壞死;冬季頂芽死亡。
繁殖寄主
菸草或(至少櫻桃分離株)歐洲甜櫻桃(Prunus avium)是適於繁殖病毒的寄主; 菸草和茴黎對於繁殖病毒以用於純化來說是有效的。
測定寄主
菸草 White Burley品種是有效的初級病斑寄主。
生物學
株系:
櫻桃和草本植物的分離株的毒力是不同的。下列毒株在血清學上(見親緣關係)和其它方面都不同:
Cropley(1961)的典型(櫻桃)毒株
Tomlinson和 Walkey(1967)的大黃毒株 。
Varney和 Moore(1952)的榆樹花葉毒株 。
Hansen(1967)及 Hansen和 Stace-Smith的金黃漿果接骨木毒株。
血清學
通常抗血清效價較低,在1/64和1/640之間。凝膠雙擴散試驗產生一條沉澱帶。春季,可用粗製的櫻桃汁液作凝膠擴散試驗(Cropley ,19 6 0)
親緣關係
植物交叉保護和血清學試驗中,櫻桃卷葉病毒和南芥花葉病毒、番茄黑環病毒、黑懸鉤子環斑病毒、番茄環斑病毒或菸草環斑病毒之間未發現親緣關係 (Cropley,1961)。榆樹花葉病毒和番茄環斑病毒之間的單向保護,使 Varney和 Moors(1952)猜測這兩病毒之間存在親緣關係,但血清學試驗(Flulton & Fulton,1970)不能證實這一點。Jones和 Murant證明,榆樹花葉病毒是櫻桃卷葉病毒的一個毒株;他們發現,從櫻桃、大黃、榆樹(=榆樹花葉病毒)和漿果接骨木(=金黃漿果接骨木病毒)分離的櫻桃卷葉病毒的分離株,在血清學上既有關而又有差異。英格蘭和荷蘭的櫻桃分離株在血清學上與蘇格蘭和北美的漿果接骨木分離株相同。Stefanac(1969)發現,南斯拉夫的漿果接骨本分離株在血清學上也與櫻桃和大黃分離株有區別。
汁液穩定性
菸草汁液中,病毒的櫻桃和漿果接骨木分離株稀釋到10-3和10-4後,在52~55℃下,10分鐘內就失去侵染性,在 20℃下,5~10天才失去侵染性(CroPley,1961;Hansen&Stace-smith)。在菸草上作試驗,櫻桃芽汁液的侵染性比菸草汁液的強(Cropley,1964)。
純化
下列方法是有效的(Tomlinson&Walkey,1967 )。在冷的 pH7.5的0.1M磷酸鉀緩衝液中,把接種10天后的菸葉勻漿,每克組織使用1.5毫升緩衝液。用細紗布壓榨勻漿,冷凍 2~3周。融化後加 0.25倍體積的氯仿。攪拌5分鐘後低速離心。再高速離心使液相澄清,沉澱在PH7.5的0.05M磷酸緩衝液中懸浮2小時,再低速離心。在上清液中加入1.0倍體積的 50%飽和硫酸銨,在20℃下放1小時。低速離心使沉澱沉降,再把沉澱懸浮在PH7.5的0.05M磷酸緩衝液中。低速離心,取出清晰的具侵染性的上清液。所有步驟是在 3 ℃下進行。製劑侵染性達10-3。
 櫻桃卷葉病毒
櫻桃卷葉病毒Hansen和 Stace-Smith用類似的方法純化金黃漿果接骨木毒株。Stace-Smith(1966)純化番茄環斑病毒的方法也可用於純化漿果接骨木毒株(A.T.Jones,私人通信), 但榆樹花葉病毒似乎較難純化,即使用這一方法也不行(Fulton & Fulton,1970)。
質粒特性
金黃漿果接骨木毒株的純化製劑沉降成兩個組分:T和B,每一組分都含侵染性的核蛋白質粒(Hansen&Stace-Smith)。高度稀釋時的沉降係數(S20,w)(Svedberge):114(T),182(B)。260/280比值:1.77(T),1.78(B)。
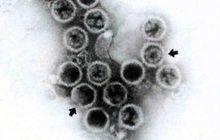
質粒結構
質粒為等軸對稱,直徑約30毫微米,外形有角。
質粒組成
核酸為RNA; 蛋白質分子量約54,000(A·T·Jones&M·A·MayO,私人通信)。
病毒與細胞和組織的關係
頂端分生組織、很尖、花粉、胚珠和成熟種子的電鏡觀察,發現內含體由裝有單排質粒的微管組成,但是感染大黃分離株的心葉煙的葉組織中,未發現這種結構(Walkey&Webb,1970)。然而,通過莖尖分生組織的培養,可以從大黃中去除這種病毒(Walkey,FitzPatrick&Woolfitt,1969)。
傳播途徑
介體傳播 :
據報導,櫻桃分離株經線蟲Xiphinema coxi,X.diversicaudatum 和X.vuitiemezi傳播(Fritzche & Kegler,1964;Flegg,1969)。榆樹花葉毒株不經線蟲 X.Americ-anum傳播(Fulton & Fulton,1970).
種子傳播:
草木寄主中,種子傳毒,苗的感染率從0.6%g至100%(Schmelzer,1966;
ListerΜrant,1967;Tomlinson&walkey,1967 ; Hansen&Stace-Smith,正出版)。榆樹花葉毒株在控制授粉實驗中,經花粉和胚珠傳至種子,但不傳至親本植株(Callahan,1957a,b)。
菟絲子傳播 :
加利福尼亞菟絲子(Cuscuta calitonica)、草地菟絲子(C.campestris)或 C.subinclusa不傳毒(Schmelzer,1966)。
檢疫與防治
由於CLRV在作物上引起的症狀不是診斷性的,可能是由幾種生物的或非生物的因素引起,而且,很多植物種類是被隱性侵染,因此,對這病毒的檢測依靠如下方法:對草本指示植物進行生物學測定和血清學測定。
(一) 指示植物的生物學測定
CLRV很容易通過機械傳播,但對木本植物似乎受到很大程度的限制。用機械接種方法接種草本植物,CLRV通常導致以下症狀:
1、 莧色藜和茴藜(Chenopodium amaranticolor和C.quinoa),在接種7天內出現局部的退綠和壞死;7天后出現系統斑駁、畸形和壞死。
2、 黃瓜(Cucumis sativus) 在接種7天內,局部出現的退綠和壞死常發展到子葉,繼而是系統壞斑。
3、 黃花煙(Nicotiana rustica )和菸草(N.tabacum)White Burley品種 在接種5天內,出現局部壞死,常有壞死環斑;依賴於生長條件,在老葉上大部分分離物導致系統性退綠或壞死環和線紋。伸長的新葉片無症狀,但含有病毒。
(二) 血清學測定
CLRV的症狀好象是由幾種病毒引起的,因此CLRV的鑑別必須通過具有特異性的血清學測定。CLRV有很大的抗血清範圍,不同病毒株系的抗血清在被利用著。對不同CLRV株系的抗血清是有用的,而且已成功地被套用在自然寄主的ELISA檢測上。利用化學發光和底物變色,核酸探針也被用於檢測此病毒。免疫捕捉RT-PCR也用於檢測此病毒。
【注】櫻桃病樹矮小,往往發病後幾年就死亡。櫻桃的症狀類似於由Pseudomonas mor-prunorum或真菌病原物所引起的樹枝開裂的症狀。雖然報導線蟲傳毒,但是並未證明這是田間傳播的主要方式。草本植物的試驗中,櫻桃卷葉病毒所引起的症狀類似於許多蠕傳多角病毒所引起的症狀,唯有血清學試驗才能鑑別。

