疾病概述
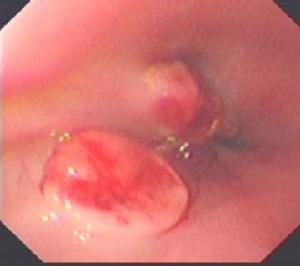 幽門管潰瘍
幽門管潰瘍由於膽汁反流先流經此處,膽汁中的膽鹽成分可使胃黏膜屏障受損,加之食糜在此停留時間較長,局部壓力增大,血液循環相對較差。過去本病少見,隨著內鏡的普及和內鏡醫師的重視,發現本病的發病率並不低。
由於潰瘍發生於胃的末端與十二指腸交界處,且其病理生理與十二指腸潰瘍相似,胃酸一般增多,部分幽門管潰瘍的腹痛類似DU;但數患者的腹痛頑固,進食後緩解不明顯,即使服用制酸劑亦不如DU顯著;另一部分患者飯後立即出現腹痛,可能因進食即引起胃幽門頻繁蠕動加劇食糜對狹小通道上的潰瘍面直接刺激所致。因此,幽門管潰瘍的腹痛無典型潰瘍的周期性和規律性。同時本病有反覆發作傾向,與幽門管平滑肌收縮功能障礙、潰瘍面不易癒合有關。
疾病病因
 幽門管潰瘍
幽門管潰瘍臨床表現
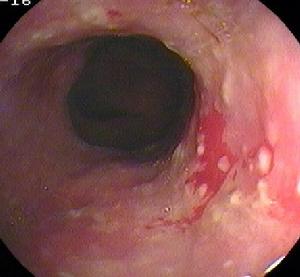 幽門管潰瘍
幽門管潰瘍2.容易並發出血:有報導約1/2的患者伴發出血,表現為嘔血或黑便,而且反覆出血,不易停止。分析其原因,系幽門弩的幽門括約肌頻繁而強烈收縮,使出血處形成的血痂容易脫落而易再發出血。
3.疼痛無明顯的特點:既可表現為飢餓痛,也可表現為餐後痛,而餐前餐後疼痛均明顯。
4.容易漏診:幽門管潰瘍行X線鋇餐檢查容易漏診,故走張行胃鏡檢查。胃鏡下可直接觀察到潰瘍的大小、形態及幽門有無梗阻、水腫等情況。
5.藥物治療效果不十分滿意:一般的潰瘍病服用藥物1~2周症狀可緩解,4~6周潰瘍可治癒,但幽門管潰瘍對抗潰鳥藥物效果略差一些,故臨床上應適當延長治療時間。大多數愚者經過嚴格合理的藥物治療可治癒。少數患者內科治療無效,或反覆復發者,或導致疤疲性幽門狹窄者主張手術治療。
病理生理
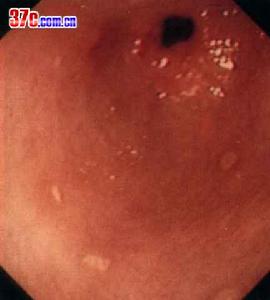 幽門管潰瘍
幽門管潰瘍1、幽門螺鏇桿菌感染近十多年來的大量研究充分證明,幽門螺鏇桿菌(Hp)感染是消化性潰瘍的主要原因。
(1)消化性潰瘍患者中Hp感染率高如能排除檢測前患者服用過抗生素、鉍劑或非甾體抗炎藥(NSAID)等因素,DU患者的Hp感染率為90%-100%,GU為80%-90%。Hp感染者中發生消化性潰瘍的危險性亦顯著增加。前瞻性研究顯示,Hp感染者中大約15%-20%的人可發生消化性潰瘍。
(2)根據Hp可促進潰瘍癒合和顯著降低潰瘍復發率根除Hp而無抑制胃酸分泌作用的治療分按可有效癒合潰瘍;用常規抑制為散分泌藥物治療療效不理想的所謂難治性潰瘍,在有效根除Hp治療後,得到痊癒;套用高療效Hp方案治療1周,隨後不再給予抗潰瘍治療,療程結束後4周複查,潰瘍的癒合率高於或等於套用常規抑制胃酸分泌藥連續治療4-6周的癒合率。這些結果從不同的角度證明了根除Hp可促進潰瘍癒合。
潰瘍頻繁複發曾是消化性潰瘍自然史的主要特點之一。用常規抑制胃酸分泌藥物治療後癒合的潰瘍,停藥後潰瘍的年復發率為50%-70%。根除Hp可使DU、GU的年復發率降至5%以下,從而使絕大多數潰瘍患者得到徹底治癒。此外,根除Hp還可顯著降低消化性潰瘍出血等併發症的發生率。
(3)Hp感染改變了黏膜侵襲因素與防禦因素之間的平衡Hp憑藉其毒力因子的作用,在胃型黏膜(胃和有胃化生的十二指腸)定植,誘發局部炎症和免疫反應,損害局部黏膜防禦修復機制;另一方面,Hp感染可增加促胃液素和胃酸的分泌,增強了侵襲因素。這兩因子的協同作用造成了胃十二指腸黏膜損害和潰瘍形成。
Hp的毒力因子包括使Hp能夠在胃型黏膜定植的因子和誘發組織損害的因子兩大類,一些因子兼有兩方面的作用。Hp的定植部位在胃黏膜上皮表面和粘液底層;一般胃竇Hp數量較多,胃體和胃底較少,亦可棲居於十二指腸胃化生黏膜。Hp在胃內定植,處要抵抗胃酸殺滅作用外,還要依靠其運動穿過粘液層。Hp菌體呈螺鏇形,一端有鞭毛,為其運用提供了動力。Hp產生的尿酶水解尿素成為氨和二氧化碳,氨在Hp周圍形成氨雲,中和周圍胃酸,從而保護Hp。Hp特異的粘附以胃上皮,使其毒素容易作用於上皮細胞。Hp的粘附特異性反映了它存在粘附因子,而胃上皮細胞存在粘附因子的特異性受體。
 幽門管潰瘍
幽門管潰瘍Hp感染可引起高促胃液素血證,其機制包括:①Hp感染引起的炎症和組織損傷使胃竇黏膜中D細胞數量減少,影響生長抑制素產生,使後者對G細胞釋放促胃液素的抑制作用減弱。②Hp尿素酶水解尿素產生的氨使局部黏膜pH升高,破壞了胃酸對G細胞釋放促胃液素的反饋抑制。
Hp感染對胃酸影響的報導不盡一致。多數報告顯示,Hp陽性DU患者的基礎、進餐和促胃液素等刺激的胃酸分泌高於Hp陽性健康志願者的基礎胃酸和刺激的胃酸分泌亦高於Hp陰性的對照者,但升高的幅度小於Hp陽性的DU患者。Hp感染所致的高促胃液素血症是引起高胃酸分泌的原因之一。
Hp感染引起消化性潰瘍的機制有多種假說。漏屋頂假說把胃黏膜屏障比喻為屋頂,保護其下方黏膜組織免受胃酸(雨)的損傷。當黏膜首先Hp損害時(形成漏屋頂)就會造成泥漿水(H+反彌散),導致黏膜損傷和潰瘍形成。這一假說強調了Hp感染所致的防禦因素減弱,可解釋Hp相關GU的發生。六因素假說將胃酸-胃蛋白酶、胃化生、十二指腸炎、Hp感染、高促胃液素血症和談散氫鹽分泌六個因素綜合起來,解釋Hp在DU發病中作用。胃竇部Hp感染、遺傳因素等引起高胃酸分泌,高酸直接損傷上皮或引起繼發炎症使十二指腸黏膜發生胃化生,為Hp在十二指腸黏膜定植創造條件。十二指腸Hp感染加重了局部炎症(十二指腸),炎症又促進胃化生。這一惡性循環使十二指腸黏膜持續處於炎症和損傷狀態,局部碳酸氫鹽分泌減少,削弱了十二指腸黏膜的防禦因素。而Hp感染所致的高促胃液素血症刺激胃酸分泌,增強了侵襲因素。侵襲因素的增強和防禦因素的削弱導致潰瘍形成。
2、胃酸和胃蛋白酶消化性潰瘍的最終形成是由於胃酸-胃蛋白酶自身消化所致,這一概念在“Hp時代”仍未改變。胃蛋白酶是主細胞分泌的胃蛋白酶原經鹽酸激活轉變而來,它能降解蛋白質分子,所以對黏膜有侵襲作用。
診斷檢查
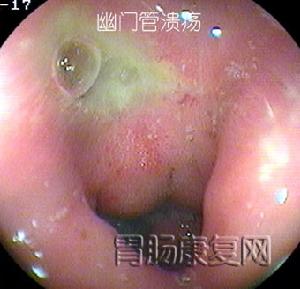 幽門管潰瘍
幽門管潰瘍2、胃液分析GU患者的胃酸分泌正常或低於正常,部分DU患者則增多,但與正常人均有很大重疊,故胃液分析對消化性潰瘍診斷和鑑別診斷價值不大。目前主要用於促胃液素瘤的輔助診斷,如果BAO>15mmol/h、MAO>60mmol,BAO/MAO比值>60%,提示有促胃液素瘤之可能。
3、血清促胃液素測定消化性潰瘍時血清促胃液素較正常人稍高,但診斷意義不大,故不應列為常規。但如懷疑有促胃液素瘤,應作此項測定。血清促胃液素值一般與胃酸分泌呈反比,胃酸低,促胃液素高;胃酸高,促胃液素低;促胃液素瘤時則兩者同時升高。
診斷:病史分析很重要,典型的周期性和節律性上腹部疼痛是診斷消化性潰瘍的主要線索。但必須指出,有潰瘍症狀者不一定患有消化性潰瘍,而相當部分消化性潰瘍患者的上腹疼痛常不典型,更有一部分患者可無疼痛症狀。因而單純依靠病史難以作出可靠診斷。確診需要依靠X線鋇餐檢查和(或)內鏡檢查,後者尤有診斷價值。
1、X線鋇餐檢查氣鋇雙重對比造影能更好地顯示黏膜象。潰瘍的X線徵象有直接和間接兩種:龕影是直接徵象,對潰瘍診斷有確診價值。良性潰瘍凸出於胃、十二指腸鋇劑輪廓之外,在其周圍常見一光滑環提,其外圍輻射狀黏膜皺襞。間接徵象包括局部壓痛、胃大彎側痙攣性切痕、十二指腸球部激惹和球部畸形等,間接徵象僅提示有潰瘍。
2、胃鏡檢查和黏膜活檢胃鏡檢查不僅可對胃十二指腸黏膜直接觀察、攝影,還可在直視下取活檢作病理和Hp檢測。它對消化性潰瘍的診斷和良、惡性潰瘍鑑別診斷的準備性高於X線鋇餐檢查。在潰瘍太小或太表淺,鋇餐檢查難以發現;鋇餐檢查發現的十二指腸球部畸形可有多種解釋難以確診;活動性上消化道出血是鋇餐檢查的禁忌證,內鏡檢查可確定其來源和性質。鋇餐檢查或內鏡下看似良性的GU中,大約5%實際是惡性的,反之少部分看似惡性的潰瘍,事實證明是良性的,不作活檢難以鑑別。此外,內鏡檢查還可發現伴隨潰瘍的胃炎和十二指腸炎。內鏡下消化性潰瘍多呈圓形或橢圓形,偶也呈線狀,邊緣光整,底部充滿灰黃色或白色滲出物,周圍黏膜可有充血、水腫,有時見皺襞向潰瘍集中。內鏡下潰瘍可分為活動期(A)、癒合期(H)和瘢痕期(S)三個病期,其中每一病期又可分為1和2兩個階段。
治療方案
 幽門管潰瘍
幽門管潰瘍1、一般治療生活要有規律,工作宜勞逸結合,要避免過度勞累和精神緊張,如有焦慮不安,應予開導,必要時可給鎮靜藥。原則上需強調進餐要定時,避免辛辣、過鹹食物及濃茶、咖啡等飲料。牛乳和豆醬雖能一時稀釋胃酸,但其所含鈣和蛋白質能刺激胃酸分泌,故不宜過飲。如有菸酒嗜好而確認與潰瘍的發病有關者,應即戒除。服用NSAID者,應儘可能停服;即使患者未服此類藥物,亦應告誡其今後慎用。
2、藥物治療70年代以前本病的治療主要依賴抗酸藥和抗膽鹼藥,H2RA的問世在治療上引起第一次變革;近年倡導的根除Hp是治療上的重大里程碑。
(1)根除Hp治療根除Hp可使大多數Hp相關性潰瘍患者完全達到治療目的。國際已對Hp相關性潰瘍的處理達成共識,即不論潰瘍初發或復發,不論活動或靜止,不論有無併發症史,均應抗Hp治療。
1)根除Hp的治療方案由於大多數抗菌藥物在腸內低pH環境中活性降低和不能穿透粘液層到達細菌,因此Hp感染不易根除。迄今為止,尚無單一藥物能有效根除Hp,因而發展了將抑制胃酸分泌藥、抗菌藥物或起協同作用的膠體鉍劑聯合套用的治療方案。根除Hp的治療方案大體上可分為質子泵抑制劑(PPI)為基礎和膠體鉍劑為基礎的兩大類。一種PPI或一種膠體鉍劑加上克拉黴素(甲紅黴素)、四環素、甲硝唑(或替硝唑)3種抗菌藥物中的2種,組成三聯療法。Hp菌株對甲硝唑耐藥率正在迅速上升。呋喃唑酮抗Hp作用強,Hp不易產生耐藥性,可用呋喃唑酮替代甲硝唑,劑量為200mg/d,分兩次服。可用H2RA替代PPI,以降低費用,但療效亦有所降低。初次治療失敗者,可用PPI、膠體鉍劑合併兩種抗菌藥物的四聯療法。
2)根除Hp治療結束後是否需繼續抗潰瘍治療對此尚未統一。治療方案療效高而潰瘍面積又不很大時,單一抗Hp治療1-2周就可使活動性潰瘍有效癒合。若根除Hp方案療效稍低、潰瘍面積較大、抗Hp治療結束時患者症狀未緩解或近期有出血等併發症史,應考慮在抗Hp治療結束後繼續用抑制胃酸分泌藥治療2-4周。
3)抗Hp治療後複查抗Hp治療後,確定Hp是否根除的試驗應在治療完成後不少於4周時進行。接受高效抗Hp方案(根除率≥90%)治療的大多數DU患者無必要進行證實Hp根除的試驗。難治性潰瘍或有併發症史的DU,應確立Hp是否根除。因GU有潛在惡變的危險,原則上應在治療後適當時間作胃鏡和Hp複查。對經過適當治療仍有頑固消化不良症狀的患者,亦應確立Hp是否根除。
(2)抑制胃酸分泌藥治療潰瘍的癒合特別是DU的癒合與抗酸治療強度和時間成正比。鹼性抗酸藥(如氫氧化鋁、氫氧化鎂及其複方製劑)中和胃酸(兼有一定細胞保護作用),對緩解樣疼痛症狀有較好效果,但要促使潰瘍癒合則需大劑量多次服用才能奏效。多次服藥的不便和長期服用大劑量抗酸藥物可能帶來的不良反應限制了其套用。目前已很少單一套用抗酸藥來治療潰瘍,可作為加強止痛的輔助治療。抗膽鹼藥哌侖西平(哌吡氮平)和促胃液素受體拮抗劑丙谷胺治療潰瘍療效不夠理想,已很少用於治療潰瘍。目前臨床上常用的抑制胃酸分泌藥有H2RA和PPI兩大類。PPI作用於壁細胞胃酸分泌終末步驟中的關鍵酶--H+-K+-ATP酶生成時,壁細胞才恢復泌酸功能。因此PPI抑制胃酸分泌作用比H2RA更強,且作用持久。目前至少有四種PPI已用於臨床,分別為奧美拉唑、蘭索拉唑、潘托拉唑和拉貝拉唑。一般劑量為奧美拉唑20mg、蘭索拉唑30mg、潘托拉唑40mg和拉貝拉唑10mg,每天一次口服;根除Hp治療時劑量需加倍。
 幽門管潰瘍
幽門管潰瘍(4)NSAID潰瘍的治療和預防對NSAID相關性潰瘍,應儘可能暫停或減少NSAID劑量,並檢測Hp感染和進行根除治療。用PPI治療,GU或DU的癒合可能不受或較少受到繼續服用NSAID的影響,故當未能中止NSAID治療時,應選用PPI進行治療。既往有消化性潰瘍病史或有嚴重疾病、高齡等因素對潰瘍及其並發不能承受者,可預防性地同時服用抗消化性潰瘍病藥。米索前列醇可預防NSAID誘發的GU和DU。PPI亦能起到預防作用,但標準劑量的H2RA則否。
(5)潰瘍復發的預防Hp感染、服用NSAID、吸菸等是影響潰瘍復發的可除去的危險因素,應儘量除去;潰瘍復發頻繁時,不要忘記排除促胃液素瘤。由於極大多數消化性潰瘍是Hp相關性潰瘍,而Hp真正根除後,潰瘍的復發率可顯著降低,因此確定有無Hp感染非常重要。需要指出的是,Hp感染根除後,或初次檢測陰性者,仍有陽性可能。出現這種情況大多是由於檢測當時未排除干擾因素,Hp暫時受到抑制而未能檢出,或由於檢測方面不夠可靠。Hp真正根除後成人的再感染率很低,約為每年1%-3%。在根除Hp治療中,由於耐藥菌株藥物不良反應、患者依從性差等因素,在一個甚至兩個療程治療後仍有部分患者的Hp未能得到根除。有併發症的潰瘍和難治性潰瘍容易復發,高齡或伴有嚴重疾病者對潰瘍及其併發症不能承受,這些都是預防復發的重點對象。維持治療曾是預防潰瘍復發的主要措施,但與根除Hp治療相比,維持治療需沉澱服藥,停藥後潰瘍仍會復發,療效也不如前者,因此需對維持治療的地位作重新評價。由於存在Hp陰性潰瘍、根除Hp後仍有少部分潰瘍會復發、目前根除治療方案的療效尚難達到百分之百以及Hp根除後仍有一定再感染率等原因,維持治療仍有一定地位。實際上,根除Hp治療與維持治療互補,才能最有效地減少潰瘍復發和併發症。維持治療一般多用H2RA體拮抗劑,常用方案為標準劑量半量睡前頓服,也可用奧美拉唑10mg/d或20mg每周2-3次口服進行維持治療。維持治療的時間長短,需根據具體情況決定,短者3-6個月,長者1-2年,甚至更長時間。
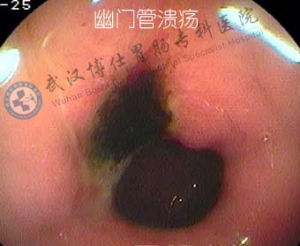 幽門管潰瘍
幽門管潰瘍 3、消化性潰瘍治療的策略對胃鏡或X線檢查診斷明確的DU或GU,首先要區分Hp陽性還是陰性。如果陽性,則應首先抗Hp治療,必要時在抗Hp治療結束後再給予2-4周抑制胃酸分泌治療。對Hp陰性的潰瘍包括NSAID相關性潰瘍,可按過去的常規治療,即服任何一種H2RA或PPI,DU療程為4-6周,GU為6-8周。也可用黏膜保護劑替代抑制胃酸分泌藥治療GU。至於是否進行維持治療,應根據潰瘍復發聘禮、患者年齡、服用NSAID、吸菸、合併其他嚴重疾病、潰瘍併發症史等危險因素的有無,綜合考慮後作出決定。至於外科治療,由於內科治療的進展,目前僅限少數有併發症者。手術適應證為:①大量出血經內科緊急處理無效時;②急性穿孔;③瘢痕性幽門梗阻;④內科治療無效的頑固性潰瘍;⑤胃潰瘍疑有癌變。
預後預防
 幽門管潰瘍
幽門管潰瘍預防:
1、首先要戒除煙、酒、濃茶、咖啡等與潰瘍發病有關的嗜好。避免使用致潰瘍藥物。
2、不要吃酸性的東西,還有酸的橘子,地瓜粉,涼的、硬的米飯。
3、採用多次、少量、刺激性小而易消化的膳食。
4、避免精神緊張,減少心理壓力。生活要有規律,勞逸結合。
