定義
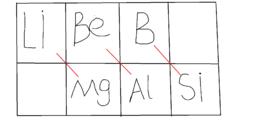
Li與Mg,Be與Al,B與Si這三對元素在周期表中處於對角線位置:
| Li | Be | B | C |
| Na | Mg | Al | Si |
產生原因
同一周期中最外層電子構型相同的離子從左至右隨離子電荷數的增加極化作用增強。
同一族元素的離子極化作用從上至下逐漸減弱。
因此,處於周期表中左上和右下對角線位置的兩元素電荷數和半徑影響相反。其離子勢相近,所以性質相近。
相似性
鋰與鎂的相似性
★ 鋰和鎂在過量的氧氣中燃燒均生成正常氧化物,而不是過氧化物。
★ 鋰、鎂都能與氮氣直接化合而生成氮化物。
★ 鋰、鎂的氟化物、碳酸鹽、磷酸鹽均難溶於水。
★ 鋰、鎂的碳酸鹽在加熱時均能分解為相應的氧化物和二氧化碳。
★ 鋰、鎂的氯化物均能溶於有機溶劑中,表現出一定的共價性。
 對角線規則
對角線規則★I A族元素中只有鋰能直接和C生成Li2C2,Mg和C生成Mg2C3
★值得注意的是,鋰的金屬性比鎂強,氫氧化鋰為強鹼,氫氧化鎂為中強鹼,鋰與水反應平緩不劇烈,鎂則很緩慢,氫氧化鋰易溶,20度是溶解度12.8g,氫氧化鎂難溶20度時溶解度0.00095g
鈹與鋁的相似性
·★鈹、鋁都是兩性金屬,標準電極電勢相近。既能溶於酸,也能溶於強鹼。
·★鈹和鋁都能被冷的濃硝酸鈍化。
·★鈹和鋁的氧化物均是熔點高、硬度大的物質。
★·鈹和鋁的氧化物,氫氧化物都呈兩性,而且氫氧化物都難溶於水。
★鈹和鋁的氟化物都能與鹼金屬的氟化物形成配合物,如Na2[BeF4],Na3[AlF6]。它們的氯化物、溴化物、碘化物都易溶於水,高價陰離子鹽都難溶。氯化物都是共價型化合物,氣態下易生成雙聚體,易升華,易聚合,易溶於有機溶劑。
硼與矽的相似性
★兩者在單質狀態下都有顯著的金屬性。
★自然界中多以氧化物形式存在,B-O和Si-O十分穩定
★氫化物多種多樣,是共價型化合物。
★鹵化物都是路易斯酸,完全水解。
★氧化物及其水化物是弱酸。
對角線規則是從有關元素及其化合物的許多性質中總結出來的經驗規律,對此可以用離子極化的觀點加以粗略地說明。同一周期最外層電子構型相同的金屬離子,從左至右隨離子電荷數的增加而引起極化作用的增強。同一族電荷數相同的金屬離子,自上而下隨離子半徑的增大而使得極化作用減弱。因此,處於周期表中左上右下對角線位置上的鄰近兩個元素,由於電荷數和半徑的影響恰好相反,它們的離子極化作用比較相近,從而使它們的化學性質有許多相似之處。由此反映出物質的性質與結構的內在聯繫。
備註
對角線規則首先是一條經驗規則,不是定理。其次對角線規則只存在在第二和第三周期元素之間。最後,在中學階段,對角線規則不是需要完全掌握的知識。