概述
 宮頸上皮內瘤變
宮頸上皮內瘤變1.宮頸不典型增生(dysplasia),是指宮頸上皮細胞部分或絕大部分被不同程度的異型細胞所替代已被公認為宮頸癌癌前病變的宮頸不典型增生,可發生於宮頸外口附近的移行區或宮頸管內膜。曾有不同的名稱,如間變(anaplasia)、核異常(dyskargosia)、不典型基底細胞增生過長(atypical basal cell hyperplasia)、不典型化生(atypical metaplasia)及結構不良不典型增生等。1966年Govan等採用不典型增生的名稱,1975年WHO規定統一名稱為宮頸不典型增生,1978年全國第1次宮頸癌協作組會議上決定採用此名稱。1988年Bathasda會議統稱CIN。
2.宮頸濕疣,是指人乳頭瘤病毒感染(HPVⅠ)所致的宮頸病變Meisels等首先研究了宮頸濕疣樣病變的問題Coppleson曾認為與HPVⅠ有關的亞臨床濕疣(SPI)具有潛在惡變的能力,應視為與CIN相關的最早期病變。
3.宮頸原位癌(carcinoma in situ),是指不典型增生的異型細胞擴展到鱗狀上皮的全層。Broder(1932)首先提出了“宮頸原位癌”的概念,亦曾用很多名稱如隱蔽性癌(incipient cancer)、浸潤前癌(preclinical cancer)非浸潤癌(non invasive cencer)上皮內癌(intraepithelial cancer)、臨床前癌(preclinical cancer)及“Bowen”病等1961年國際婦產科聯盟(FIGO)將原位癌列為宮頸癌分期中的O期。
4.宮頸腺上皮內瘤變(cervical intraepithelial glanduIar neoplasia,CIGN),過去研究甚少,定義尚不明確,近年由於宮頸腺癌的發病增加,引起了人們的重視。Gloor和Hurlimann(1986)建議採用宮頸腺上皮內瘤變這一名稱,與鱗狀上皮內瘤變相仿,亦包括腺性不典型增生和原位腺癌。有學者描述腺性不典型增生是介於正常宮頸管腺上皮和腺原位癌之間的腺上皮病變,認為原位腺癌是浸潤性腺癌的癌前病變。
病因
 宮頸上皮內瘤變
宮頸上皮內瘤變1.人類乳頭狀瘤病毒感染 隨著人類乳頭狀瘤病毒(HPV)感染與下生殖道關係研究的不斷深入發現HPV感染與子宮頸癌前病變的發生有著一定的關聯HPV感染作為一種特殊類型的性傳播疾病是子宮頸上皮內瘤樣病變發生的病因。分子生物學及流行病學研究表明人類乳頭狀瘤病毒有致癌性。HPV根據其致癌性不同可分為不同類型:HPV16,18,45,56為高危型HPV31,33,35等11種為中危型,HPV6,11,26等8種為低危型。CINⅠ及亞臨床HPV感染常為HPV6,11型,CINⅢ80%為HPV16型感染
子宮頸重度不典型增生其細胞內染色體常伴有HPV基因的整合,從而啟動E1、E2基因,導致病毒基因在宮頸上皮內的表達,其後E6、E7基因編碼合成多功能蛋白從而干擾細胞生長在16、18型高危的HPV感染者起著重要的細胞癌變作用高危型HPV E6蛋白可與腫瘤抑制基因p53結合,導致p53降解,E7基因產物是一種核磷酸蛋白與腫瘤抑制基因retinoblastoma基因(PRb)產物結合導致其功能滅活,從而影響其抑制細胞生長的作用
2.其他因素
(1)吸菸:吸菸與宮頸上皮內瘤樣病變的發生有一定關係,其降解物尼古丁與致肺癌類似的宮頸刺激性,在宮頸上皮內瘤樣病變的發生中起重要作用。
(2)微生物感染:淋球菌、單純皰疹病毒(HSV)、滴蟲感染可增加對HPV的易感性,從而與宮頸上皮內瘤樣病變的發生有關。
(3)內源性與外源性免疫缺陷:免疫缺陷病毒的感染可致CIN的發生增加,如Hodgkin病、白血病、膠原性血管病與HPV感染性疾病發生有關。
發病機制
 宮頸上皮內瘤變
宮頸上皮內瘤變1.宮頸不典型增生。鱗狀上皮不典型增生細胞既具有異型性,又保持分化能力。鏡下特點為:①細胞核增大、深染,大小形態不一;②染色質增多粗大;③核漿比例增大;④核分裂增多;⑤細胞極性紊亂至消失。根據細胞異型程度及上皮累及範圍,宮頸不典型增生又分為輕、中、重三度(或三級)。
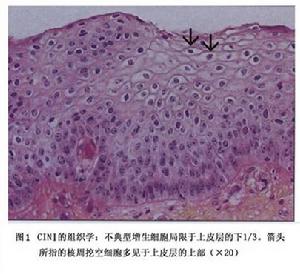
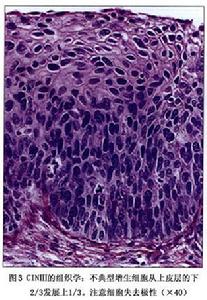
(1)輕度不典型增生(或稱Ⅰ級):細胞異型性輕,異常增生的細胞僅限於上皮層的下1/3,中、表層細胞正常。
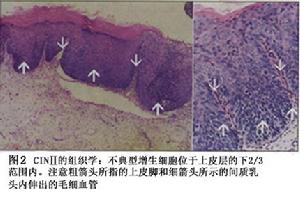
(2)中度不典型增生(或稱Ⅱ級):細胞異型性明顯,異常增生的細胞限於上皮層的下2/3未累及表層。
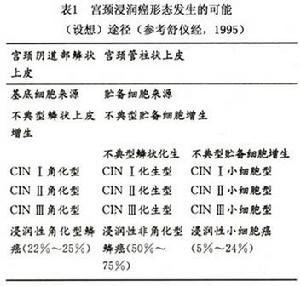
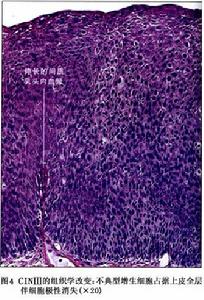
(3)重度不典型增生(或稱Ⅲ級):細胞異型性顯著異常增生的細胞占據上皮內2/3以上或達全層。
2.宮頸濕疣。組織學上分3類:①外生型,鏡下呈乳頭狀生長;②內生型,上皮向間質內生長;③扁平型,最為常見,缺乏上述二型的特點,但細胞具有不典型改變易誤認為CIN。
Meisels等曾首先描述的主要鏡下特點為:
(1)上皮中表層出現挖空細胞,細胞增大核呈現異型性,可見雙核或多核,核周胞漿中有不規則的空暈區域,而外周的胞漿緻密
(2)棘細胞增生
(3)表層可見過度角化或不全形化細胞。
(4)間質乳頭狀增生向表面突起。其中挖空細胞是HPVI最典型的表現。1981年該作者又指出挖空細胞是濕疣和不典型增生的主要鑑別點,並詳細描述挖空細胞的組織學表現。
3.宮頸原位癌
(1)宮頸原位鱗癌的基本特點:癌細胞僅限於上皮內,基底膜完整,無間質浸潤。病理特徵為:①細胞排列紊亂,無極性;②細胞核大,核漿比例增大;③核異型性大,染色深淺不一;④異常核分裂象多見,在上皮各層均可發現。
(2)根據發生部位形成3類不同的細胞類型:①大細胞角化型;②大細胞非角化型;③小細胞型。原位癌累及腺體十分常見,仍具有基底膜完整而無間質浸潤的特點。原位癌累及腺體是指不典型增生的鱗狀上皮細胞向基底部伸展,累及宮頸管黏膜中的腺體頸部,腫瘤邊界清晰周圍間質無炎性反應,並可見殘留的高柱狀腺管上皮如累及的腺體明顯膨大、變形或互相融合、細胞分化不良時易發生浸潤,應予重視,需與鏡下浸潤鑑別。
(3)由Friedll和Mckay描述的原位腺癌的病理特徵為:
①常發生於頸管下段移行帶附近。
②也可局限於一個宮頸管黏膜息肉內。
③可累及成組的腺體結構或單個腺體呈芽狀生長入間質,使腺體呈篩狀改變,由上皮細胞構成的乳頭亦可穿入腺體內或突出於頸管表面,但並非浸潤。
④原位腺癌由假復層柱狀上皮構成(舒儀經等,1995)。
4.CIN分級
(1)CIN根據細胞的異型程度也分為三個級別:
①CINⅠ級:相當於極輕度和輕度不典型增生。
②CINⅡ級:相當於中度不典型增生
③CINⅢ級:相當於重度不典型增生和原位癌。
(2)最近有作者提出根據CIN細胞的成熟程度分為三個亞型:①角化型;②非角化型;③小細胞型。認為這一分類將提供一個較完善的使組織病理學和細胞病理學相互聯繫的形態學基礎,並與宮頸癌的致癌機制的構想途徑相關(表1)。
CINⅠ:上皮成熟,核異常少,有絲分裂少見圖1。未分化的細胞限於上皮深層(下1/3)。有絲分裂象可見,但不多,HPV感染的細胞病理變化在全層上皮均可觀察到。
CINⅡ:不典型增生的細胞變化主要在上皮下的1/2或1/3核異常比CINⅠ明顯見圖2。上皮下1/2可見到核分裂象。
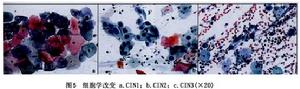
CINⅢ:上皮分化和分層可以缺乏或僅在上皮表層的1/4出現並伴有許多核分裂象(圖3,4),核異常可遍布上皮全層,許多核分裂象有異常。
細胞學者、病理學者和陰道鏡學者互相溝通可提高三個級別CIN的報告水準。尤其有助於鑑別輕度CIN。
臨床表現
 宮頸上皮內瘤變
宮頸上皮內瘤變CIN一般無明顯症狀和體徵,部分有白帶增多、白帶帶血、接觸性出血及宮頸肥大、充血、糜爛、息肉等慢性宮頸炎的表現,正常宮頸也占相當比例(10%~50%)故單憑肉眼觀察無法診斷CIN,見表2。多數文獻報導約半數原位癌患者無臨床症狀舒儀經(1995)統計172例原位癌,僅5.2%有接觸性出血,12.2%有少量的不規則出血,其餘無症狀李楠等(2001)統計150例CIN中,白帶增多和接觸性出血者分別占26.0%和20.7%,無症狀者占38.0%。
併發症:
不典型增生原位癌常與浸潤癌並存。
症狀
一、CIN一般無明顯症狀和體徵,部分有白帶增多、白帶帶血、接觸性出血及宮頸肥大、充血、糜爛、息肉等慢性宮頸炎的表現,二、正常宮頸也占相當比例(10%~50%)故單憑肉眼觀察無法診斷CIN。
三、多數文獻報導約半數原位癌患者無臨床症狀舒儀經(1995)統計172例原位癌,僅5.2%有接觸性出血,12.2%有少量的不規則出血。
四、其餘無症狀李楠等(2001)統計150例CIN中,白帶增多和接觸性出血者分別占26.0%和20.7%,無症狀者占38.0%。
診斷
 宮頸上皮內瘤變
宮頸上皮內瘤變由於CIN常缺乏典型的臨床表現,根據臨床檢查難以診斷CIN,趨於藉助多種輔助診斷方法的聯合使用但最後確診須靠病理檢查。宮頸細胞學塗片+宮頸多點活檢(碘染肉眼觀察VIA或陰道鏡下)+頸管刮術已成為CIN和早期宮頸癌普遍採用的綜合早診方法早診技術方面有較大進展。
鑑別診斷
宮頸上皮內瘤變應與正常化生及亞臨床濕疣鑑別。
CIN經巴氏宮頸細胞學塗片染色可在顯微鏡下進行鑑別在細胞學製片中觀察單個細胞的改變進行CIN診斷和分級。組織學診斷還可觀察到整個組織的其他特徵,細胞學評價CIN基於細胞核和細胞質的改變,經常很難判斷(圖5)。
所有不典型增生細胞核不同程度增大和形態多樣是公認的。另一個主要的特點是核深染核染色體分布不均形成團塊狀有絲分裂象和核仁較少見。表層或中層細胞出現異常核仁多為低度CIN而附基底層和基底層核仁異常則為高度CIN胞漿量和核大小的關係(核漿比例)是評價CIN級別的最重要依據之一核漿比例增高,CIN級別越高同一張細胞學塗片中經常出現各種變化的細胞,包括有診斷爭議的細胞需有經驗的細胞學專家鑑別。
檢查
 宮頸上皮內瘤變
宮頸上皮內瘤變實驗室檢查:
1.細胞學檢查 自1941年Papanicloaou和Traut創立用陰道脫落細胞學診斷方法以來,長期的臨床實踐證明此法具有簡便易行、經濟有效及多次重複的特點,已成為婦科常規檢查的重要內容及宮頸癌普查中首選的初篩工具。從臨床角度來看以下幾點值得重視:
(1)診斷的正確率:細胞學陽性確診率雖達95.4%,但不同作者報導的準確率差異很大(67%~92.6%),且有一定的假陰性和假陽性。檢出CIN的假陰性為10%~35%,甚至高達50%(Coppleson,1992)。細胞學診斷的準確性主要取決於以下因素:
①取材部位:是影響塗片質量的關鍵常規在宮頸外口的鱗柱交界處取材,但因有一定比例的宮頸癌起源於頸管特別是腺癌及絕經前後婦女或宮頸局部治療後鱗柱交界上移故應重視宮頸管部位的取材。目前主張雙份塗片法(即同時取宮頸和頸管塗片)及重複塗片,有助於提高塗片質量和陽性率。有學者報告隨機採用宮頸“雙取器”及小腳板取材,二者比較結果顯示異常細胞檢出率有顯著差異,分別為85.7%和42.8%“雙取器”具有使用方便一次完成雙份塗片的優點但在宮頸萎縮時頸管取材困難。上海有採用小戟式刮板的,認為適用於老年患者。有研究發現,常規塗片有80%以上的細胞隨取材器被丟棄可見細胞學的取材工具還需改進。
②加強質量控制提高製片、染色技術及診斷水平:塗片質量差影響診斷的正確性,占40%。液基細胞學幾乎保留了取材器上的全部標本,製成的薄層塗片提高了塗片質量,便於閱片觀察。
(2)統一診斷標準,套用新的報告方式(TBS):長期以來國內外大多採用傳統的巴氏五級分類法,隨著細胞病理學的進展,在開闊陰道細胞學診斷範圍中逐漸感到巴氏分級法已不能適應疾病的診斷和臨床要求。1988年WHO提出套用描述性報告和與CIN一致的報告系統,同年美國國立癌症研究所提出Bethesda系統TBS報告方式在臨床實踐中正逐步完善此報告系統
(3)宮頸濕疣的診斷:20世紀70年代後期逐漸認識,Meisels(1981)提出不典型濕疣是癌前病變,細胞學檢出濕疣的陽性率低普查中濕疣的檢出率為3%~4%,Meisels(1992)報告普查中濕疣占3.23%,不典型濕疣占0.57%。濕疣的細胞學形態與CIN相似,其空穴細胞易誤認為癌細胞,不典型濕疣常誤診為浸潤性角化性癌應予重視,注意識別。濕疣的細胞學特徵為:
①核周空穴細胞或挖空細胞
②角化不良細胞。
③濕疣外底層細胞。
(4)重視宮頸腺癌的細胞學診斷:多數人認為宮頸腺癌不易早期發現早期診斷大多是在細胞學預示CIN後組織學檢查才意外發現。細胞學診斷腺癌的陽性率低,為48%左右,近年報導細胞學的陽性預測值為71%~79%(Laverty,1988),常規刮取宮頸外口及頸管塗片可能會提高腺癌的檢出率。
2.塗抹醋酸肉眼觀察(VIA) VIA是指宮頸表面塗抹3%~5%醋酸溶液後,無放大條件下肉眼直接觀察宮頸上皮對醋酸的反應程度根據醋白上皮的厚薄、邊界輪廓和消失的快慢等作判斷,20世紀90年代後已用於開發中國家和經濟落後地區的宮頸癌篩查Belinson等(2001)報告VIA在宮頸癌篩查中的靈敏度和特異度分別為70.9%和74.3%,此法簡便易行,經濟有效。
3.碘溶液試驗 又稱為Schiller試驗。是將碘溶液塗在宮頸上觀察其染色的部位。正常子宮頸鱗狀上皮含糖原,糖原與碘混合後產生深赤褐色或深棕色,不染色為陽性。宮頸炎宮頸癌前病變及宮頸癌的鱗狀上皮缺乏糖原或不含糖原,塗碘後不染色,有助於定位異常上皮,識別危險的病變,以便確定該組織檢查取材的部位。
子宮頸異常部位確定後應確定其外周及遠端的邊界。通過上述溶液的套用,陰道鏡下通常可識別其病變下極,但偶爾病變可延伸至陰道穹隆。病灶的上緣可用陰道鏡觀察其鱗柱交界處。
其它輔助檢查:
1.陰道鏡檢查及陰道鏡引導下的活檢
(1)陰道鏡檢查:陰道鏡檢查是一種簡單而有效的診斷子宮頸有無病變的方法,肉眼不能看出的異常上皮及異常毛細血管,通過陰道鏡檢查可清楚地看到。陰道鏡下異常上皮的特徵包括:
①細胞和細胞核密度的增加。
②鱗狀上皮輪廓不規則,並伴有特殊的血管變化,表現為點狀(punctation)或鑲嵌(mosaic)。前者是由於上皮內扭曲或彎曲的毛細血管斜行達表面,後者是由於血管擴張,排列成蜂窩狀,內上皮島分開而成
③白色上皮是CIN的第一特徵,在上皮表面有一層厚的角化蛋白。
陰道鏡檢查能進一步幫助發現病變部位,從而指導宮頸部位正確活檢,但不能區別原位癌與不典型增生。陰道鏡檢查結果正確與否與是否全面觀察到移行帶有關
(2)陰道鏡引導下宮頸活檢:子宮頸活檢是診斷CIN最可靠的方法,在陰道鏡引導下對可疑部位行多點活檢是明確CIN診斷的最好方法,取下的活檢組織應有足夠深度,包括鱗狀上皮並有足量的間質組織最好能取到其周圍組織。
2.宮頸活檢及頸管刮術 CIN和宮頸癌的診斷必須依據宮頸活體組織的病理檢查。
宮頸活檢時需注意以下幾點:①宜在碘染VIA或陰道鏡下進行多點活檢,分別標記送病檢;②取材包括病灶及其周圍組織;③咬取宮頸上皮及足夠的間質組織;④臨床或細胞學可疑時應重複取活檢或切取活檢。
頸管刮術(ECC):刮取頸管內膜組織送病理檢查有助於明確頸管內有無病變和CIN或癌是否累及頸管,但是否作為常規檢查目前尚無一致意見。頸管刮術的指征為:①細胞學異常或臨床可疑的絕經前後婦女,尤其懷疑腺癌時;②陰道鏡下病變累及頸管;③細胞學多次陽性或可疑,陰道鏡檢查陰性或不滿意或陰道鏡下活檢陰性者。
3.宮頸錐形切除 是宮頸癌傳統可靠的診斷方法,由於陰道鏡的廣泛開展,診斷性錐切率明顯下降。20世紀90年代國外有幾組報導比較陰道鏡下活檢和錐切活檢在診斷CIN和浸潤癌中的作用,結果相當(Coppleson,1992)。診斷性錐切指征為:
(1)細胞學多次陽性,陰道鏡檢查正常或看不到全部轉化區或陰道鏡下活檢和ECC陰性者。
(2)細胞學報告與陰道鏡下定位活檢或頸管刮術結果不符
(3)VIA或陰道鏡下活檢疑有早期浸潤。
(4)級別較高的CIN病變延伸至頸管內
(5)懷疑腺癌者。臨床或陰道鏡檢查可疑浸潤癌者為手術禁忌證
4.宮頸環形電切術(LEEP)和大環狀宮頸轉化區切除(LLETZ) 自20世紀90年代後較廣泛地套用於CIN的診治,故也具有診斷和治療的雙重作用。
治療
 宮頸上皮內瘤變治療
宮頸上皮內瘤變治療1.治療原則
近代對CIN的治療策略是趨於保守,原因為:①CIN和早期癌的綜合診斷水平提高;②宮頸癌的發生、發展經歷較漫長的時間,有10年左右;③有20%~50%的不典型增生發生逆轉或自然消退;④絕大多數CIN病灶局限,保守性治療一次性治癒率高達90%左右;⑤原位癌的5年生存率為100%。但至今國內外對CIN的處理尚存不少爭論。
(1)CINⅠ級及宮頸SPI是否治療,意見不一。CIN自然轉歸的研究提示級別低的CIN有高的自然逆轉率,多數與低危的HPV感染有關,進展為癌的機會極少,近年認為CINⅠ級是一種不穩定狀態,對這些最早的癌前病變應採用隨診觀察,不予治療(Jordan,1989;舒儀經,1995)。反之,不少作者認為CIN患者都應進行處理,而不論其與病毒及分型關係如何,主要從宮頸癌防治角度出發應持積極態度而給予適宜的癌前阻斷治療。
Syrjäaen(1987)主張SPI的處理應與CIN相同,醫科院腫瘤醫院結合文獻和自己的經驗認為對以下情況可採用保守性治療:①宮頸濕疣合併CIN;②與高危型HPV(16,1831,33,45…)有關的CIN Ⅰ;③病變範圍大又無隨診條件或精神緊張拒絕觀察者。必須指出切勿採用過分積極的治療方案。
(2)對CIN Ⅲ級採用保守治療,分歧較大:國外文獻中報導保守性治療的失敗率較高,Ostergard(1980)報告用冷凍治療CIN Ⅲ級的失敗率達39.0%,Benedet等(1981)報告用冷凍治療後有浸潤癌的發生,故認為CIN Ⅲ級不宜採用冷凍治療。另有作者研究343例CIN Ⅲ級錐切標本,99.7%的腺體累及深度<3.8mm(Anderson等,1980),這不僅給保守治療提供了依據,同時又提示治療需達一定深度,才能得到充分治療。文獻中屢見保守治療CIN Ⅲ級的報導,一次性治癒率達77%~96%(表3)。
然而鑒於以下原因:
①CIN Ⅲ級進展到癌的機會明顯增多,65%以上的重度不典型增生可發展成原位癌,18%~36%的原位癌進展為浸潤癌。
②CIN Ⅲ級常與早期浸潤或浸潤癌並存,診斷水平的差異可能導致診斷不充分而漏診。
③CIN Ⅲ級經保守治療後需密切隨診,而國內多數患者來自農村,缺乏長期隨診條件等。
因此,對於已無生育要求的CIN Ⅲ級者全子宮切除是最好的治療選擇
 宮頸上皮內瘤變
宮頸上皮內瘤變(3)宮頸錐切術用於原位癌的治療,迄今仍有不同看法,國外較廣泛採用,但文獻中多數報導錐切術後復發率高於全子宮切除術後。Demopoulos等(1991)報導96例CIN Ⅲ採用宮頸錐切術,切緣陽性率達39.6%,術後8周行子宮切除術,38.5%有殘存病灶。Parson(1978)報導錐切後殘餘或復發癌為3.2%~9.1%。Coppleson等(1992)收集13位作者的資料,術後殘存病灶達12%~60%。Chang曾研究172例宮頸錐切後子宮切除的病理標本,發現錐切邊緣陽性和殘存病灶的發生率,在高度鱗狀上皮內病變(HSIL,包括Ⅱ、Ⅲ級)中分別為18.6%和23.3%,殘存病變在錐切邊緣陽性中的比例顯著高於邊緣陰性者分別為84.8%和10.1%。可見錐切治療原位癌是不徹底的,並有遺漏浸潤癌的可能。有不少報導傳統錐切術(CKC)成功地治療宮頸原位癌(Mohamed等1997)
綜上所述,CIN的治療也應遵循個體化原則,治療方法的選擇主要取決於CIN的級別、病變範圍年齡、生育要求、醫療條件及醫師的經驗等。總的治療對策為:對CINⅠ、Ⅱ級,採用冷凍雷射等局部治療;對CIN Ⅲ級,國內以手術切除子宮為主,國外有主張採用局部治療者。對年輕、有生育要求、病變範圍小的CINⅠ級患者可以隨訪觀察而對病變局限、年輕、有生育要求或要求保留子宮的CIN Ⅲ級者可行錐形切除。
局部治療CIN的效果主要與下列因素有關:①CIN級別,病變大小;②治療深度;③整個轉化區是否被去除;④合併反覆或持續HPV感染(尤其高危型HPV);⑤頸管是否受累;⑥治癒標準隨診時間醫師經驗等。
因此,採用局部治療需注意以下幾點:①治療前必須詳細檢查準確診斷,並須排除浸潤癌;②治療前應做ECC檢查;③月經乾淨後5~7天后進行;④宜在碘染、VIA或陰道鏡直視下治療;⑤治療達足夠深度,不應少於4mm,治療範圍應包括宮頸的全部病變(以超出病變3~5mm為宜)、整個轉化區及頸管下段;⑥治療後應長期隨診,包括細胞學、陰道鏡和病理。
 宮頸上皮內瘤變
宮頸上皮內瘤變2.CIN常用的治療方法
(1)冷凍治療(cryosurgery):冷凍治療CIN的文獻報導較多,CINⅠ、Ⅱ級的治癒率可達90%~97%,而CIN Ⅲ級的治療效果較差80%~90%,但也有報導達96%(Levine,1985)。Coppleson等(1992)統計15位作者的治療結果,總治癒率為83.5%其中CINⅡ、Ⅲ級的治癒率分別為91%和77.8%說明隨CIN級別的增加治癒率明顯下降。
冷凍治療簡易有效冷凍最大的優點就是沒有電灼所產生的疼痛治療深度與電灼一樣,也可達3~4mm。不過,少數病人因為需要重複治療,尤其在行深部治療時仍會感覺不舒服可能是子宮收縮的結果Richard等人以及其他報導最多的16位作者,都認為用冷凍治療所有的CIN失敗率為1%~8%。其中CINⅠ是零失敗率。值得注意的是失敗後再次冷凍治療可減少CINⅡ的失敗率到3%,減低CIN的失敗率到7%。冷凍所採用的冷煤、二氧化碳(carbon dioxide)或一氧化氮(nitrousoxide),結果都是一樣。惟治療時,壓力不能低到40kg/cm2。與子宮頸接觸的探頭(probe)部分,除了中間呈乳突狀外,四周應該是4~5mm寬。同時,為了均勻及快速冷凍,探頭部分可抹上一層薄薄的水溶性潤滑油,則更為理想。
一般認為冷凍治療宜用於病變局限的CINⅠ、Ⅱ級,為提高治癒、減少復發,冷凍治療需注意以下幾點:
①根據宮頸形態及病變範圍等選用相應的冷凍頭,應以覆蓋整個病灶為宜。冷凍頭端應塗一薄層水溶性潤滑劑作為介質,提高穿透性增加與宮頸的均勻接觸,使溫度迅速傳遞
②冷凍劑用CO2或液氮溫度在-75℃以下,壓力是冷凍成敗的重要因素,必須始終保持在3.92×106Pa(40kgf/cm2)以上,以保證冷凍能力,探頭周圍要在1.5~2min內形成保持4~5mm厚度的冷球。
③套用兩次即兩個凍融期以達到較好療效。
 宮頸上皮內瘤變
宮頸上皮內瘤變(2)雷射治療:Bellina和Poleshchuk等於20世紀70年代套用CO2雷射治療婦科腫瘤,80年代國內外文獻報導治療CIN的效果,Towensend(1983)比較雷射和冷凍治療CIN(各100例)的結果,失敗率分別為11%和7%。Coppleson綜合文獻一次治癒率為76%~98%。上海醫科大學婦產醫院報導用雷射治療CIN 220例,轉常率為65.5%,高於其他療法復發率為5.8%。
雷射一般都在陰道鏡下操作,所放出的能量由點狀光束釋出,並由組織吸收,除可摧毀組織並可將其蒸發。雷射的觸煤也是二氧化碳。連續的治療比斷續的治療效果要好。深度可達5~7mm。惟治療時不可用易燃物品,例如酒精、消毒劑等此外,治療時產生的煙霧可用吸管吹掉,讓視野更清楚一些。除了有組織破壞較深的好處之外,雷射至少有兩種壞處:比電灼、冷凍還要痛,這是深部組織破壞後的必然現象,也因此而出血較多依Parashevadis等人的報導,總失敗率是5.6%(119/2130)。在40歲以上病人以及CIN Ⅲ的失敗率最高,達75%,CINⅠ最低,為7%所有的病人在雷射治療2年後有3位發現有侵犯性癌此外,Townsend和Richard報導100位病人用雷射治療,另100位病人用冷凍治療,失敗分別為11及7人,表示沒有統計學上的差別因此他們的結論是,既然這兩種方法的治療結果都一樣,就可考慮用於門診,方便病人最不痛又可省錢的方法,就是冷凍和電灼。
雷射治療具有操作簡便、治療精確、組織癒合快及併發症少的優點。20世紀90年代有作者採用CO2光導纖維傳輸雷射的報導,操作靈便,並可進入內腔治療。Baggish等(1985)套用雷射切割和氣化綜合治療CIN,治癒率達97%對分娩影響甚少。有學者曾用雷射錐切治療473例CIN隨診5年以上,治癒率為96.6%,復發率為3.4%,認為雷射錐切適用於頸管刮術陽性、陰道鏡檢查不滿意、CIN面積大、35歲以上及拒絕保守治療者。
(3)電凝治療(electro coagulation diathermy):國外不少報導用電凝治療CIN,在美國、歐洲和澳洲一開始便很普遍,以後延及世界各個角落。對CIN的治療效果,因為電灼治療深度可達3~4mm,應該毫無疑問。對CINⅠ和CINⅡ的治療,幾乎也沒有失敗的報導,但極少數CINⅡ潛藏CIN Ⅲ甚或侵犯性癌,因此在治療前應該仔細檢查,包括陰道鏡甚至切片,以及必要時的子宮頸擴刮術(dilatation and curettage,D&C)。對CIN Ⅲ,治療失敗率約13%零期癌有無腺體侵犯者沒有區別。Chanen與Rome報導人數最多達1734人。所有病人(CINⅠ~CINⅢ)的失敗率只有3%,都在門診進行。只有少數病人需要深部電灼,才足以破壞較深的病變組織包括腺體,需要麻醉藥,可能需要住院。至於可能發生的子宮頸狹窄(cervical stenosis),其實很少,惟在深部電灼後發生的可能性比較高。不妨在電灼的同時行子宮頸擴刮術,可以減少此副作用的發生。優點是治療面積較廣,深度可達3~4mm,治療效果可達90%~95%Chanen和Rome(1983)報導用電凝治療CIN 1864例,其中2/3的病例為CIN Ⅲ級,一次治癒率為97%,但電凝不宜過深,否則會引起疼痛和術後出血,故治療時常需麻醉。
(4)宮頸環狀電切術(loop electrosurgical excision procedureLEEP)或轉化區大環狀切除(large-loop excision of the transformation zone,LLFTZ):LEEP由法國學者Cartier(1981)首創,是一種新型電切療法。20世紀90年代以來國外陸續報導採用LEEP術治療CINALVarez等(1994)Messing等(1994)對錐切、雷射和LEEP三種方法治療CIN 110例進行隨機研究,結果提示LEEP具有快速簡便、廉價、併發症少、便於門診治療等優點近年對LEEP的診治指征、切除範圍和存在問題進行了較多的臨床研究結合文獻和經驗,認為下列指征較為適宜。
①LEEP術的指征:
A.LEEP作為診斷方法的指征:
a.細胞學為ASCUS或AGC陰道鏡檢查無明顯異常者
b.細胞學或陰道鏡檢查懷疑HSIL。
c.陰道鏡檢查不滿意,細胞學異常者。
B.LEEP治療的指征:
a.持續CINⅠ無隨診條件者,或CINⅠ伴高危型HPV感染。
b.CINⅡ
c.CINⅢ中重度不典型增生。有報導LEEP治療宮頸原位腺癌的復發率為29.0%,故原位癌尤其是原位腺癌不宜用LEEP治療(Widrich等,1996)。
②LEEP的治療範圍及效果:LEEP術的錐切範圍應超過宮頸病變外1mm,深度7mm,頸管深度15mm左右。若用於CINⅠ或ASC時宮頸深度和頸管深度均為4mm即可(卞美璐等,2000)LEEP治療CIN的治癒率為89.4%~93.3%。併發症的發生率為2.7%~14.1%,主要是術後出血
③LEEP術存在的問題:LEEP這一新治療方法的套用時間較短,存在不少問題,如LEEP能否作為排除浸潤癌的診斷方法、是否適宜於原位癌的治療、熱損傷是否影響錐切邊緣組織的病理評估、治療不足或治療過頭等等,文獻報導不一尚待進一步探討。
(5)宮頸錐切術:是國內外常用的傳統治療方法,歐洲曾廣泛用於CIN的治療,但因不少作者報導錐切術後殘存病灶及復發率高,又有一定的併發症因此多數學者主張應嚴格掌握錐切的適應證,在年輕未育的原位癌患者的治療中仍有一定地位,此外對病灶局限、拒絕或不能耐受大手術的CIN Ⅲ級者,亦可採用錐切術
錐狀切除尤其適合重度CIN和CIS,既可診斷,又可治療顯微侵犯癌中如果只有極少的侵犯,也都可以考慮錐狀切除。此手術經過陰道,若把切下的子宮頸倒過來看呈圓錐形,故又稱錐狀切除或圓錐切片。手術時子宮頸的轉換區(transformation zone)即鱗狀上皮和柱狀上皮細胞交界處一定要看到,而宮頸管擴刮(endocervical curettage)的標本必須沒有癌細胞。為了做好這個工作,通常先暴露子宮頸先用沾有生理鹽水的棉棒將子宮頸表面的黏液洗乾淨,最後用4%醋酸均勻塗在子宮頸上,醋酸與上皮層病灶所產生的蛋白凝結而呈白色,切除部分的邊緣就得涵蓋所有的白色地帶因此形狀不一定是圓形,切口以病灶為準。當然需要多留些邊緣,就是邊緣不能有殘留病灶。在陰道鏡引導下做這個手術最好,惟一般臨床醫師如果事先已有良好的陰道鏡檢查結果,手術時候能用醋酸協助範圍的測定,切下足夠的邊緣,當可減少殘留病灶和復發,圓錐切下來的標本邊緣仍有癌細胞的時候,需要第二次切除,因為在有問題的邊緣偶爾會有侵犯癌。我們另外的建議是,可以先做抹片,如果抹片結果正常可以先觀察。除非是有子宮頸狹窄影響了抹片的結果,才做第二次切除。
由於錐狀切除一定合併做宮頸管擴刮手術,因此可使用麻醉藥物,全麻、局麻均可。可使用深度鎮靜劑,時間為15~20min。手術用的刀片種類很多,如電刀、一般刀片以及雷射刀無論在止血、病理判讀上都幾乎沒有太多的差別。對比較常見的出血問題,電灼確實有很好的止血效果。手術結束前,若在傷口再放上一片止血網(surgicel)或泡沫膠(gel foam),則止血效果更好相反用子宮頸上下的上皮向內口並將四周包起來的縫法(Sturmdorf suture),止血效果一般。目前,這些合併症已不常見錐狀切除後可能引發子宮頸狹窄以及子宮頸閉鎖不全(incompetentcervix),則更是少見。至於切除的邊緣不易判讀的CIN病人,如果在手術後第一年抹片都正常的話效果良好。以後出現不正常抹片的幾率只有0.4%。Kolstad等人在追蹤做了錐形切除的795例原位癌(CIS)5~25年後,發現復發原位癌僅有2.3%(19/795),侵犯癌是0.9%(7/795)Bjerre等人的原位癌復發率則只有0.6%,侵犯癌為0.6%。依台北榮民總醫院的統計(1998),775位原位癌追蹤5年以上原位癌的復發率為0.25%(2/775),侵犯癌為0.13%(1/775)。
環形切除(loop electrosurgical excision procedure.LEEP)在20世紀90年代風靡一時,是錐狀切除的另一種方法,在可以見到子宮頸的轉換區後做一個環狀切除。一般深度可達5~8mm,也具有診斷和治療效果。
20世紀90年代後文獻中將傳統的宮頸錐切術稱為冷刀錐切(CKC),在重視生存質量的今天,觀念的更新和技術的提高,使人們重新認識到冷刀錐切在CIN診斷和治療中的價值,目前CKC的臨床套用增多,已成為CIN患者的一個重要治療手段。
為減少錐切術後復發,錐切術時應強調以下幾點:
①宜在碘染、VIA和(或)陰道鏡下進行。
②切除範圍包括陰道鏡下所見異常病變、整個轉化區、全部鱗柱交界及頸管下段,切除寬度在病灶外0.5cm,深度至頸管內口以下,一般2.0cm左右。
③錐切標本須作詳細的病理檢查,尤其是標本邊緣和錐頂組織檢查有無殘存病灶。
錐切術後的近期併發症主要是出血(5%~10%),遠期併發症有宮頸管狹窄、宮頸內口鬆弛,以致發生晚期流產或早產等。
(6)全子宮切除術:是宮頸原位癌最常用而徹底的治療方法,在癌前病灶,尤其是CINⅡ及CIN Ⅲ已經不再想生育的人,或者合伴有其他子宮、卵巢和輸卵管疾病者,譬如良性腫瘤,通常都會做子宮切除;若合併有以前比較常見的子宮下垂(uterine prolapse)則多半會從陰道做全子宮切除(vaginal hysterectomy)。針對原位癌Kolstad等人提出的報告,238位接受子宮切除病人中,長期追蹤5~25年的結果:復發率(原位癌)1.2%(3/238),侵犯癌2.1%(5/238)與錐狀切除比較,雖然有數字上的差別,但是沒有統計學上的差別。跟Bjerre等人(3729人)的看法在統計學上幾乎一樣:子宮切除後原位癌的復發率0.9%,侵犯癌0.3%。
至於手術為了減少復發,以往醫師都會多切除部分上陰道。Creasman和Rutledge等人在分析861位病人後,強調沒有這個必要,他們認為子宮頸原位癌的復發與切除陰道的多少無關。按各作者所分析人數的多少列在下表以供參考(表4,56)。
對已無生育要求或中老年的CIN Ⅲ級患者,全子宮切除術也是優先選擇的治療方法。但對是否同時切除部分陰道仍意見不一,Greasman及Rutledge曾研究發現原位癌的復發與陰道壁切除無關,主張不必擴大手術。Parson等(1978)強調切除適當的陰道壁,以最大限度地減少復發的危險。但人們注意到“高危原位癌”的問題,認為多個腺體、深層腺體、頸管高位及淺層病變廣泛多中心性癌變,特別是最易波及陰道上段,對這類所謂“高危原位癌”的處理,單純子宮切除顯然不妥,施行筋膜外擴大全子宮切除或次廣泛子宮切除較為適宜。
(7)放射治療:凡有手術禁忌證或拒絕手術的原位癌患者,採用單純腔內放療即可。
(8)原位腺癌和腺上皮內瘤變的處理:由於對腺癌的自然發展史不甚了解對ACIS和CIGN處理的報導也很少,但最近幾組研究值得引起關注。Poynor等(1995)報告28例ACIS錐切標本中40%有殘存病灶,錐切邊緣陰性者有43%復發,總復發率達47%,其中13.3%為浸潤癌提示ACIS具有多病灶特點,常與浸潤性腺癌並存Kenned等(1996)報導細胞學診斷無明確意義的不典型腺上皮細胞(AGUS),77例中至少4%有浸潤癌,13%有癌前病變,其中1例在4個月內發現腺癌,作者認為對這些“高危”患者需進一步評價,包括陰道鏡、頸管刮術和內膜病理檢查。Azodi等曾報告40例原位腺癌的治療結果,冷刀錐切LEEP和雷射錐切術後宮頸管內切緣陽性分別為24%、75%和57%,對有生育要求的患者,作者推薦CKC評價原位腺癌以排除浸潤性腺癌,此外,對錐切活檢邊緣陰性和ECC陰性的原位腺癌也主張採用Ⅰ型子宮切除術。對ACIS和CIGN的處理目前尚無一致意見,鑒於其特有的生物學行為宜在仔細檢查、全面評價、準確診斷後給予與CIN不盡相同的恰當處理。
食物禁忌
宮頸上皮內瘤變患者吃什麼對身體好?
1、宮頸癌(即子宮頸癌)早期對消化道功能一般影響較小,以增強患者抗病能力,提高免疫功能為主,應儘可能的補給營養物質,蛋白質、糖、脂肪、維生素等均可合理食用。當患者陰道出血多時,應服用些補血、止血、抗癌的食品,如藕、薏苡仁、山楂、黑木耳、烏梅等。當患者白帶多水樣時,宜滋補,如甲魚、鴿蛋、雞肉等。當患者帶下多粘稠,氣味臭時,宜食清淡利濕之品,如薏苡仁,赤小豆,白茅根等。
2、手術後,飲食調養以補氣養血,生精填精之膳食,如山藥、桂圓、桑椹、枸杞、豬肝、甲魚、芝麻、驢皮膠等。
3、維生素營養不良。有人觀察宮頸癌患者血中B-胡蘿蔔素低於對照組,B-胡蘿蔔素攝入量低為宮頸癌危險因素。另外,維生素C也與宮頸癌發病率有關,我國調查表明維生素C攝入量增加時,子宮頸癌危險降低。
4、微量元素。現已發現與微量元素銅、鋅、硒有關。貴州腫瘤防治所研究發現宮頸癌、乳腺癌顯著差異,現期和遠期復發者血漿銅則顯著高於非復髮長存者和正常人。遠期復發者血漿銅則顯著高於非復發組。銅比值以遠期復發者最高。現期組銅鋅比值亦顯著高於正常及非復發組。血漿銅與銅鋅比值可作為診斷宮頸癌病與惡性腫瘤與預後的指標。有人調查宮頸癌患者患病與銅攝入量高有關,可能因銅有拮抗硒的作用,大劑量銅可在動物身上產生缺鎧硒症狀。因此,日常飲食中應注意補充維生素,適當注意補充含鋅、硒元素的食物。
宮頸上皮內瘤變患者吃什麼對身體不好?
(1)宮頸癌由氣血瘀滯,痰濕凝聚,毒熱蘊結而致。用膳應禁忌肥膩甘醇、辛辣香竄,油煎烤炸等生濕、生痰、燥熱,易致出血的食品。
(2)患者白帶多水樣時,忌食生冷、瓜果、冷食以及堅硬難消化的食物;帶下多粘稠,氣味臭時,忌食滋膩之品。
預後預防
 宮頸上皮內瘤變
宮頸上皮內瘤變預後:
Richart曾指出CIN的異型程度越高、累及上皮厚度越深,發展為浸潤癌的可能性越大,反之級別低的CIN逆轉到正常的機會越多。CIN有三種轉歸:①消退(或逆轉);②持續不變(或病情穩定);③進展(或癌變)
1.CIN轉歸相關因素
(1)HPV型別:有研究提示HPV型別是CIN轉歸的相關因素(Richart等,1987)。持續高危HPV感染髮生宮頸癌的危險性增加250倍。Campion等(1986)對100例CINⅠ級隨診2年余,高危HPV 16,18型陽性者,56%進展為CIN Ⅲ級,而低危HPV6型陽性者僅20%有進展。
(2)CIN程度:隨CIN級別的增高發展到浸潤癌的幾率增加,大體上CIN有15%可發展為宮頸癌,其中CINⅠ、ⅡⅢ級發展到癌的危險性分別為15%、30%和45%見表7Mill等(1992)報導CINⅠ、Ⅱ、Ⅲ級進展到浸潤癌的危險性分別為正常婦女的4倍、14.5倍和46.5倍。
(3)年齡:隨年齡增長,CIN病變的逆轉率下降。Mill等發現35~39歲CIN患者的總逆轉率為77%,40歲以上則為61%。
(4)其他:如CIN的干預治療、隨診時間等。
2.關於SPI的轉歸 多數學者認為SPI具有與CIN相似的臨床和生物學特性,目前對SPI的轉歸雖有爭議但20世紀80年代以來的幾組報導提示HPV也有三種轉歸,且與HPV的型別有關。Rome和Chanan等(1987)報告259例未治療的SPI,隨診18個月其中16%有進展,39%持續不變,45%消退Syrjanen等(1987)報導宮頸細胞學診斷HPVⅠ的513例中,25%進展為CIN,60%持續不變,14%消退。
3.宮頸原位癌的轉歸 多數認為原位癌可進展為浸潤癌,僅少數自然消退或經活檢後消失也有作者認為原位癌不會自然消退Mcindoe等(1984)報導300例未治療的原位癌,隨訪10~20年,轉浸潤癌率分別為18%和36%。楊學場等(1992)觀察了69例拒絕治療的原位癌患者,其中26%在平均5.2年內發展為浸潤癌。
預防:
有些學者認為不需特殊治療,可隨訪觀察,因為低的HPV感染而致的陰道鏡下所見的輕度病灶,其惡變的機會較小。有些認為應進行治療,因為少部分CINⅠ為高危型HPV感染,其有贅生性趨向。

