簡介
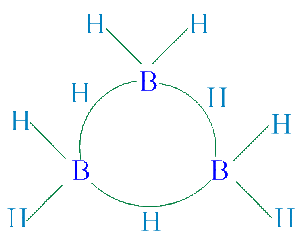 定域鍵
定域鍵價鍵理論把構成兩個原子間共價鍵的電子對看作在這兩原子之間運動,稱為定域鍵。只包含定域鍵的多原子分子可以
看成是由相對獨立的兩個原子之間的化學鍵把原子連線起來形成的,這是忽略了相鄰化學鍵的影響,而把描述雙原子分子中化學鍵的方法用到多原子分子的定域鍵上。如乙烯中有一個C-C和四個C-H σ鍵、一個C-C π鍵。定域鍵具有比較恆定的鍵性質。例如,一定類型定域鍵的鍵長、鍵偶極矩、鍵極化度、鍵力常數、鍵能等在不同分子中近似保持不變。因此,分子的有關廣延性質可近似表示為相應的鍵性質之和。定域鍵的這種特點在化學中得到廣泛的套用,例如從鍵能計算分子的原子化能近似值。
離域MO理論和定域MO理論
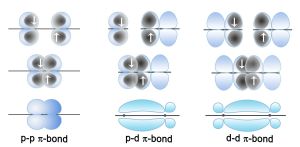 定域π鍵圖
定域π鍵圖這兩種理論所反映的物理圖象不同:離域鍵描寫單個電子在整個分子內運動的行為;
定域鍵描寫所有價電子在定域軌道區域內的平均行為。
但二者在本質上是等價的,離域(正則)分子軌道是分子體系單電子Schrödinger方程的本徵解,但不是唯一解,通過一定的變換方式可將離域分子軌道定域化。以CH4分子為例,如忽略組合係數,有
ψ'a=ψs ψx ψy ψz=(1/2)(s px py pz) 1sa
 電子-模型圖
電子-模型圖 ψ'b=ψs ψx-ψy-ψz=(1/2)(s px-py-pz) 1sb
ψ'c=ψs-ψx-ψy ψz=(1/2)(s-px-py pz) 1sc
ψ'd=ψs-ψx ψy-ψz=(1/2)(s-px py-pz) 1sd
可見CH4分子的定域分子軌道由離域分子軌道線性組合得到。
