四氧化三鉛
四氧化三鉛,化學式PbO,可視為PbO·2PbO之複合物,俗稱 鉛丹。常溫時為鮮紅色粉末。與油類相調和後,塗在鐵器上,可防止生鏽。
製備:由一氧化鉛在空氣中加熱至500℃製得:
6 PbO + O→ 2 PbO
產物中含有雜質一氧化鉛,可用氫氧化鉀溶液提純:
PbO + KOH + HO → K[Pb(OH)]
四氧化三鈷
同時含有二價鈷和三價鈷,分子式也可以記為CoCoO或CoO·CoO。CoO晶體結構為尖晶石構型,其中O作立方緊密堆積;Co離子為四配位,填充於四面體空隙;Co離子為六配位,填充於八面體空隙。
四氧化鋨
四氧化鋨是化學式為OsO的化合物。儘管鋨在地殼中含量稀少,四氧化鋨仍有很多用途。它有很多有趣的性質,其中之一是揮發性。純四氧化鋨是無色的,但因通常混有少量二氧化鋨(OsO)而呈黃褐色。OsO可溶於四氯化碳(CCl),微溶於水,與水反應生成鋨酸。OsO具有揮發性,常溫下易升華。氣味與臭氧相似。鋨的名稱起源於希臘文的“osme”,意思是“臭味”。
四氧化銥
四氧化銥是由氧和銥組成的無機化合物,化學式是IrO,銥的氧化態是+8。四氧化銥可以由在絕對溫度6K(−267°C, −449°F)下的固態氬中[IrO]的光化學重排來製備。此氧化物是較溫度時會不穩定。已有報告提出用紅外線多光子解離偵測到四氧化銥陽離子,氧化態為+9的紀錄。
四氧化鐵
四氧化鐵是一種無機化合物,化學式為FeO,結構簡式為(O)FeO,其中鐵的氧化態為+6。它是鐵元素的最高價氧化物,1987年時由金屬鐵製成的陽極在強鹼性溶液中溶解製得,也有用雷射蒸發產生的鐵原子和氧氣,在氬基質中反應的製備方法。其化學性質不穩定,具有很強的氧化性。
四氧化氯
四氧化氯是一種氯氧化物,化學式為ClO。1923年,著名自由基化學家摩西·岡伯格提出碘單質與高氯酸銀在無水乙醚中反應可製得四氧化氯:
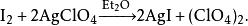 四氧化物
四氧化物但後來有研究認為生成的是高氯酸碘,然而至今沒有可靠證據說明高氯酸碘的存在。
直到1968年,伊休斯(Eachus)在77K下用γ射線照射氯酸鉀才製得它。它是七氧化二氯分解反應的活性中間體。
通過高氯酸鹽的晶格能數據經熱力學循環計算,可得出四氧化氯的電子親和能為561kJ/mol。
該物質的結構不確定,分子對稱性可能為C或C。
四氧化氙
四氧化氙(化學式:XeO)是稀有氣體氙的氧化物之一,黃色晶體,溶於水生成高氙酸,溶於鹼生成高氙酸鹽。四氧化氙只在-35.9°C以下穩定,高於該溫度時爆炸性分解為氙和氧氣。
四氧化氙中,氙原子的氧化態為+8,所有的價電子都用於成鍵。其他的氙氧化物包括三氧化氙,二氧化氙以及存在於固態氬中的XeOO陽離子。
四氧化二銻
四氧化二銻是一種無機化合物,化學式為SbO。這種物質存在於黃銻礦(cervantite)中。它是白色固體但在加熱時可逆的變黃。這種物質的最簡式為SbO,但被稱作四氧化二銻來表明其中有兩種價態的銻原子。
四氧化三錳
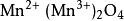 四氧化物
四氧化物四氧化三錳是一種無機化合物,化學式為MnO。四氧化三錳是一種黑色四方結晶,經灼燒成結晶,屬於尖晶石類,離子結構為,其中二價和三價錳離子分布在兩種不同的晶格位置上。氧離子為立方緊密堆積,二價錳離子占四面體空隙,三價錳離子占八面體空隙。溫度1443K以下時四氧化三錳為變形的四方晶系尖晶石結構,變形原因為姜-泰勒效應;1443K以上則為立方尖晶石結構。
室溫下四氧化三錳是順磁性,但在41~43K以下時則有亞鐵磁性。
四氧化三錳在自然界中以黑錳礦形式存在,是最穩定的氧化物。不溶於水,可溶於鹽酸。
四氧化三鐵
四氧化三鐵是鐵的氧化物,化學式為FeO,有時被寫成FeO·FeO。